
- •Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
- •Лабораторна робота № 1
- •Основні теоретичні відомості
- •Хід роботи
- •Лабораторна робота № 2
- •Хід роботи
- •Лабораторна робота № 3
- •Хід роботи
- •Лабораторна робота № 4
- •Хід роботи
- •Лабораторна робота № 5
- •Хід роботи
- •Лабораторна робота № 6
- •Хід роботи
- •Лабораторна робота № 7
- •Хід роботи
- •Лабораторна робота № 8
- •Хід роботи
- •Контрольні запитання і завдання до самостійної роботи
Міністерство освіти і науки України
Криворізькій технічний університет
Кафедра хімії
Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
для студентів І і II курсів
напрямів «Екологія» та «Гірництво»
усіх форм навчання
спеціальностей:
6.070801 «Екологія»
6.090302 «Збагачення корисних копалин»
І частина
м. Кривий Ріг
2007
Укладачі: канд. хім. наук, доц. Часова Е.В., викл. Івчук В.В.,
канд. хім. наук, доц. Мовчан О.Г.
Відповідальний за випуск: викл. Івчук В.В.
Рецензент: канд. хім. наук, доц. Єрмак Л.Д.
Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії містять основні теоретичні відомості, питання для самоконтролю, список літератури, що рекомендується для самостійного опрацювання.
Розглянуто Схвалено
на засіданні кафедри хімії на вченій раді
Протокол № металургійного факультету
Від 2007 р. Протокол №
Від 2007р.
Лабораторна робота № 1
ТЕМА: Добування і властивості вуглеводнів аліфатичного ряду
Основні теоретичні відомості
Вуглеводні - речовини, молекули яких складаються з двох хімічних елементів: карбону і гідрогену.
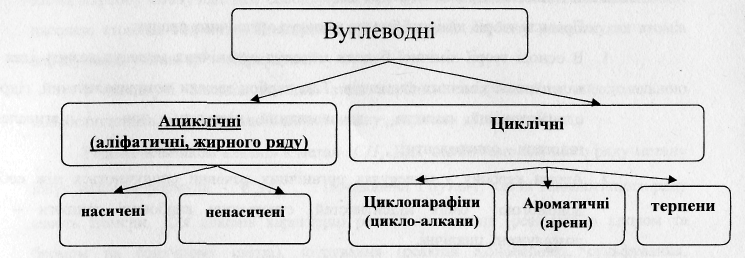
Структуру молекул насичених вуглеводнів та їх ізомерію пояснюють за допомогою теорії хімічної будови органічних сполук О.М. Бутлерова.
Основні положення теорії:
а) показано позитивні та негативні сторони існуючих до нього теорій, що пояснювали будову молекул органічних сполук, - теорії типів і радикалів;
б) підкреслено значення теорії атомності як основи будови молекул кожної органічної речовини;
в) подано визначення поняття хімічної будови органічної сполуки як поширення впливу властивих атомам сил спорідненості валентності, у результаті якої атоми опосередковано або прямо впливають один на одного, сполучаючись у хімічну частинку;
г) сформульовано вісім правил утворення хімічних сполук;
д) вперше звернено увагу на те, що різна реакційна здатність окремих хімічних сполук пояснюється більшою або меншою енергією, за допомогою якої атоми сполучаються у молекули, а також повним або неповним використанням одиниць спорідненості при утворенні зв'язків;
е) сформульовано положення про взаємний вплив атомів і атомних груп у молекулах органічних речовин.
Основні принципи хімічної теорії хімічної будови, органічних сполук О.М. Бутлерова: у молекулах органічних сполук існує певний порядок хімічного зв'язку атомів, що називається хімічною будовою; поняття про хімічну будову веде до припущення про можливість існування речовин, які мають цілком однаковий склад і однакову величину частинок, але зовсім різних між собою внаслідок різної хімічної будови; принцип хімічної будови, який заздалегідь вказує хімічний характер ізомерів повністю пояснює звичайні явища ізомерії складних речовин.
Правила теорії хімічної будови молекул органічних сполук:
В основі теорії хімічної будови молекул органічних молекул лежить ідея сталої валентності хімічних елементів. Так, карбон завжди чотиривалентний, гідроген - одновалентний, оксиген - двовалентний, нітроген – три - і п'ятивалентний, галогени - одновалентні.
Атоми карбону у молекулах органічних речовин сполучаються між собою за допомогою своїх валентностей, створюючи карбонові ланцюги - прямі, розгалужені, циклічні.
Атоми карбону можуть сполучатися між собою у ланцюги і цикли за допомогою інших хімічних елементів - оксигену, нітрогену, сульфуру, фосфору.
Атоми карбону можуть витрачати на сполучення між собою по одній, дві, три і чотири валентності, утворюючи прості, подвійні і потрійні зв'язки.
Усі чотири валентності атома карбону рівноцінні - однозаміщені найпростіших вуглеводнів (метану, етану, пропану і т.д.) не мають ізомерів.
Атоми різних хімічних елементів, що входять до складу молекул органічних сполук , не мають вільних валентностей. Валентності атомів карбону насичені валентностями інших хімічних елементів або насичені між собою з утворенням одинарних, подвійних або потрійних зв'язків.
Для кожної речовини існує єдина структурна формула, яка відбиває її основні фізичні й хімічні властивості.
Ізомерія органічних сполук, за якої дві і більше органічних сполуки мають однаковий хімічний склад, молекулярну формулу і молекулярну масу, але різні фізичні й хімічні властивості, зумовлена різною хімічною будовою їхніх молекул або просторовим розміщенням у них атомів.
Насичені вуглеводні (алкани) називають за трьома номенклатурами: історичною (тривіальною), раціональною, міжнародною (IUРАС - ІЮПАК) Міжнародна Спілка Теоретичної і Прикладної хімії.
Якщо у якої-небудь молекули алкану відняти один атом гідрогену, то частину молекул з вільною валентністю називають радикалом.
Алкани - (насичені вуглеводні) - найпростіші вуглеводні, у молекулах яких атоми карбону сполучені між собою простими (σ-) зв'язками, а всі інші валентності насичені атомами гідрогену. Електронні орбіталі атомів карбону у молекулах атомів перебувають у стані sp3 - гібридизації.
У молекулі алканів кожний атом карбону сполучений з максимальною кількістю атомів гідрогену, що й дало їм назву „насичені вуглеводні".
Родоначальником
алканів є метан СH4.
Для членів гомологічного ряду метану
існує загальна формула -
![]() .
Починаючи з бутану, члени гомологічного
ряду мають ізомери. Для алкенів характерні
реакції заміщення (реагують з хлором
та бромом на сонячному світлі), нітрування
(реакція Коновалова), сульфування,
окислення.
.
Починаючи з бутану, члени гомологічного
ряду мають ізомери. Для алкенів характерні
реакції заміщення (реагують з хлором
та бромом на сонячному світлі), нітрування
(реакція Коновалова), сульфування,
окислення.
Алкени (ненасичені вуглеводні етилового ряду або олефіни) містять у складі своєї молекули один подвійний зв'язок. Найпростіший представник алканів - етилен Н2С = СН2. Для молекул алкенів характерна наявність подвійного зв'язку між атомами карбону. Атоми карбону, сполучені між собою подвійним зв'язком, перебувають у стані sp2 - гібридизації. В утворенні такого зв'язку беруть участь одна s - і дві р - орбіталі, що приводять до утворення трьох рівноцінних орбіталей. Подвійний зв'язок - сполучення ковалентних σ - зв'язків і π - зв'язків. У реакціях приєднання кожний sp2 - гібридизований атом карбону стає sp3- гібридизованим:
H2C = CH2 + X2 → H2CX – CH2X
Це призводить до перетворення одного π - зв'язку на два σ - зв'язки.
Ненасичені вуглеводні мають загальну формулу СnН2n. Вони здатні вступати у реакції приєднання гідрогену, галогенів, галогеноводнів (за правилом Марковнікова). Ці сполуки окислюються атомарним киснем, за наявності каталізатора вступають у реакції полімеризації та ізомеризації, горять.
Алкіни
— ненасичені вуглеводні ацетиленового
ряду мають загальну формулу CnH2n-2.
Найпростішим представником є ацетилен
НС![]() СН.
Характерна наявність одного потрійного
зв'язку між двома атомами карбону.
Потрійний зв'язок є сполученням одного
σ
- зв'язку і двох π - зв'язків. При цьому
атом карбону, що бере участь в
утворенні
потрійного зв'язку, перебуває у третьому
валентному стані — sp - гібридизації.
Для алкінів характерні такі типи реакції
й електрофільного приєднання АЕ
(за σ
-зв'язком), електрофільного заміщення
SE
(за атомом гідрогену кінцевого потрійного
зв'язку), утворення ацетиленідів,
полімеризації й конденсації з альдегідами
і кетонами; нуклеофільного приєднання
an (реакції з ціанідною кислотою і спиртами
за наявності алкоголятів).
СН.
Характерна наявність одного потрійного
зв'язку між двома атомами карбону.
Потрійний зв'язок є сполученням одного
σ
- зв'язку і двох π - зв'язків. При цьому
атом карбону, що бере участь в
утворенні
потрійного зв'язку, перебуває у третьому
валентному стані — sp - гібридизації.
Для алкінів характерні такі типи реакції
й електрофільного приєднання АЕ
(за σ
-зв'язком), електрофільного заміщення
SE
(за атомом гідрогену кінцевого потрійного
зв'язку), утворення ацетиленідів,
полімеризації й конденсації з альдегідами
і кетонами; нуклеофільного приєднання
an (реакції з ціанідною кислотою і спиртами
за наявності алкоголятів).
Дієнові вуглеводні (дієни, алкадієни) - насичені вуглеводні з відкритим ланцюгом, у молекулах яких між атомами карбону є два подвійних зв'язки. Загальна формула – CnH2n-2. Розрізняють три групи дієнових вуглеводнів: з кумульованими, ізольованими та спряженою системою подвійних зв'язків.
У молекулі бутадієну - 1,3 (дивініл) СН2 =СН - СН =СН2 атоми карбону перебувають у стані sp - гібридизації. Вони утворюють дев'ять σ - зв'язків, що розміщуються в одній площині, а також два спряжених зв'язки, що лежать у площині, перпендикулярній до σ - зв'язків. Така особливість будови дає можливість приєднувати різні реагенти як до першого й четвертого атомів карбону бутадієну (1,4 - аддукт), так і до першого й другого (1,2- аддукт).
Для дієнів характерні реакції приєднання, окислення, горіння, полімеризації.
