
- •Теплотехика. Лекция 1.Основные понятия термодинамики. Смеси газов. Теплоёмкость. Термодинамика и тепломассообмен
- •1.Основные понятия и определения
- •1.1.Рабочие тела, их свойства и характеристики.
- •1.2.Молекулярно-кинетическая теория газов
- •1.3. Универсальное уравнение состояния идеального газа
- •1.4. Смесь идеальных газов
- •Задачи тестов
- •1.5. Теплоемкость газа
- •Вопросы тестов Теплоемкость
- •Задачи тестов
1.3. Универсальное уравнение состояния идеального газа
Подставляя
(1.2) и (1.3) в (1.1), получим
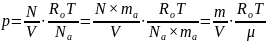 ,
где m
– масса газа, кг.
,
где m
– масса газа, кг.
Отсюда получаем уравнение состояния идеального газа Клапейрона – Менделеева:
p·V
=
 R0T
(1.4),
R0T
(1.4),
Используя величину «удельный объем»– отношение объема вещества к его массе. . (1.5)
получим
это уравнение в виде p·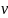 =
=
 T
(1.6)
T
(1.6)
Удельный
объём является величиной, обратной
плотности
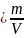 ,
,
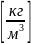 :
:
v (1.7)
(1.7)
Подставив
Rμ
=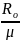 ,где
Rμ
,где
Rμ
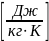 -
газовая постоянная
данного газа, в
(1.4), получим
-
газовая постоянная
данного газа, в
(1.4), получим
 (1.8)
(1.8)
В
уравнениях (1.4), (1.6) и
(1.8) p
– давление[Па], V
– объём[м3],
– удельный
объём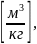 m–масса
газа [кг], μ - молярная масса газа
m–масса
газа [кг], μ - молярная масса газа
 ,
Т – температура [К]
,
Т – температура [К]
Например, для кислорода
 =
=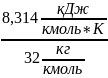 =
= .
.
Уравнение состояния описываются тремя параметрами: давлением, удельным объёмом и температурой. Два из них независимы, а третий определяется в зависимости от первых двух по уравнению (1.8).
Уравнение (1.8) носит обобщенный характер. Из него как частные случаи вытекают ранее полученные экспериментальными методами законы идеальных газов.
Изотермический процесс. Закон Бойля – Мариотта. T = const. pv = const (1.9)
Изобарический
процесс. Закон Гей-Люссака. Р
= const.
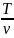 =
const (1.10)
=
const (1.10)
Изохорический
процесс. Закон
Шарля. V = const.
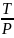 =
const (1.11)
=
const (1.11)
1.4. Смесь идеальных газов
П од
газовой смесью
понимается смесь отдельных газов, не
вступающих между собой ни в какие
химические реакции. Каждый газ (компонент)
в смеси независимо от других газов
полностью сохраняет все свои свойства
и ведет себя так, как если бы он один
занимал весь объем смеси.
од
газовой смесью
понимается смесь отдельных газов, не
вступающих между собой ни в какие
химические реакции. Каждый газ (компонент)
в смеси независимо от других газов
полностью сохраняет все свои свойства
и ведет себя так, как если бы он один
занимал весь объем смеси.
1.Сосуд наполнен двумя различными газами, разделёнными нематериальной перегородкой. Под действием давления справа и слева перегородка установится в положении, при котором р1 = р2 = р0.
2.Пусть Т1 = Т2 = Т0. Удалим перегородку. Vсм = V1 + V2.
3.Поочерёдно откачаем один из газов, установятся парциальные давления р1 и р2.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
4.Сожмём газы до прежних объёмов. Парциальный объём (V1 и V2) – тот, который газ занимал бы при р = рсм и Т = Тсм.
Количество и температура
первого газа в стадиях
 и
и
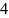 одинаково. Из уравнения состояния для
этих стадий p1·Vсм
= pсм·V1,
отсюда p1
= r1
pсм.
одинаково. Из уравнения состояния для
этих стадий p1·Vсм
= pсм·V1,
отсюда p1
= r1
pсм.
Газовая смесь подчиняется закону Дальтона:
Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
рсм = р1 + р2 + р3 + . . .рn = ∑ рi , (1.12)
где р1 , р2 , р3 . . .рn – парциальные давления.
Состав смеси задается
долями объемными r,
r1
=
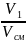 ; r2
=
; r2
=
 ; (1.13)
; (1.13)
массовыми
g g1
=
 ;
g2
=
;
g2
=
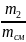 ;
(1.14)
;
(1.14)
и мольными r1′:
r1′
=
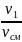 ;
r2′
=
;
r2′
=
 ;
(1.15)
;
(1.15)
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
r1 = r1′ ; r2 = r2′ ; (1.16)
Так как V1 +V2 = Vсм и m1 + m2 = mсм , то r1 + r2 = 1 , (1.17)
g1 + g2 = 1. (1.18)
Парциальное давление: p1 = r1 pсм.
Молярная
масса смеси:
μсм
= μ1
r1
+ μ2
r2.
μсм
=
 (1.19)
(1.19)
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь между объемными и массовыми долями следующее:
g1
= r1∙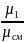 ;
g2
= r2∙
;
g2
= r2∙
Газовая
постоянная смеси: Rсм
= g1
R1
+ g2
R2
=
R0

Rсм
=
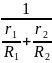 . (1.21)
. (1.21)
Удельные
массовые теплоемкости смеси: ср
см.
= g1 ср1
+ g2
ср2.
(1.22)
ср1
+ g2
ср2.
(1.22)
сv см. = g1 сv1 + g2 сv2 (1.23)
Удельные молярные теплоемкости смеси: μср см. = r1 μср1 + r2 μср2. (1.24)
μсv см. = r1 μсv1 + r2 μсv2 (1.25)
