
- •1. Периодический закон и периодическая система химических элементов д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •Значение периодического закона
- •2. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы.
- •3. Виды химической связи: ионная, ковалентная (полярная, неполярная); простые и кратные связи в органических соединениях.
- •Простые и кратные связи
- •5. Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе д. И. Менделеева.
- •6. Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе.
- •7. Высшие кислородсодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств.
- •8. Классификация неорганических соединений.
- •9. Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
- •10. Неметаллы, их положение в периодической системе химических элементов д. И. Менделеева, строение их атомов.
- •11. Классификация химических реакций в неорганической и органической химии.
- •По изменению степени окисления.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •12. Обратимость химических реакций. Химическое равновесие и способы его смещения: изменение концентрации реагирующих веществ, температуры, давления.
- •Диссоциация кислот, щелочей и солей
- •15. Реакции ионного обмена в водных растворах. Условия их необратимости.
- •16. Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
- •17. Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
- •18. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •19. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •20. Общие способы получения металлов.
- •21. Окислительно-восстановительные реакции (на примере взаимодействия алюминия с оксидом железа (III), азотной кислоты с медью).
- •22. Окислительно-восстановительные свойства серы и ее соединений.
- •24. Промышленный способ получения серной кислоты: научные принципы данного химического производства. Защита окружающей среды от химических загрязнений.
- •25. Причина многообразия неорганических и органических веществ; взаимосвязь веществ.
12. Обратимость химических реакций. Химическое равновесие и способы его смещения: изменение концентрации реагирующих веществ, температуры, давления.
Реакции, протекающие при данных условиях как в прямом, так и в обратном направлении, называются обратимыми.
N2 + 3H2 2NH3 + Q
Одну из реакций называют прямой (→), другую обратной (←). В таких реакциях сколько молекул образуется в единицу времени, столько и расходуется.
При изменении условий (температуры, давления и концентрации) состояние равновесия нарушается. Смещение химического равновесия определяется по принципу Ле Шателье:
если на систему, находящуюся в равновесии, оказывать какое-либо воздействие, то равновесие смещается в направление ослабления этого воздействия.
Рассмотрим смещение равновесия на примере окисления оксида серы (IV):
2SO2 + O2 2SO3 + Q
2V + 1V = 2V
1. Реакции идёт с выделением тепла, при повышении температуры равновесие смещается влево, то есть в сторону обратной реакции, так как это смещение ослабит воздействие температуры.
2. При повышении давления равновесие смещается в сторону реакции, ведущей к уменьшению объёма. Данная реакция идёт с уменьшением объёма: взаимодействуют 2 объёма оксида серы (IV) + 1 объём кислорода = 3 объёма, а образуется 2 объёма оксида серы (VI), поэтому равновесие сместится вправо.
3. При увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции (вправо).
Таким образом, чтобы сместить равновесие в данной реакции вправо, нужно: уменьшить температуру, увеличить концентрацию исходных веществ и увеличить давление.
Катализаторы в равной степени ускоряют как прямую, так и обратную реакции и поэтому не смещают равновесие, но ускоряют наступление равновесия.
13. Скорость химических реакций. Зависимость скорости от природы, концентрации веществ, температуры, катализатора.
Одни химические реакции протекают мгновенно (реакции обмена, взрыв горючих газов), другие – медленно (ржавление железа).
Условия, влияющие на скорость химических реакций:
Природа реагирующих веществ.
Металлы с одним и тем же веществом – водой – реагируют с различными скоростями:
Na+H2O→ быстрая реакция; Mg+H2O→ медленная реакция.
Концентрация реагирующих веществ.
С увеличением концентрации скорость реакции увеличивается, так как число столкновений между молекулами возрастает. Например, горение в чистом кислороде протекает значительно интенсивнее, чем в воздухе, где концентрация кислорода почти в пять раз меньше.
3. Поверхность реагирующих веществ.
С измельчением вещества скорость реакции увеличивается.
4. Повышение температуры.
При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2-4 раза, так как возрастает скорость движения молекул и увеличивается вероятность их столкновения. Например, кислород при обычной температуре медленно окисляет многие вещества, а при повышении температуры начинается бурная реакция – горение.
5. Катализаторы.
Катализаторы – вещества, ускоряющие химические реакции, но сами при этом не расходуются.
14. Электролиты и неэлектролиты. Электролитическая диссоциация неорганических и органических кислот, щелочей, солей.
Электрический ток — направленное движение заряженных частиц под действием внешнего электромагнитного поля.
Электролиты — вещества, растворы (и расплавы) которых проводят электрический ток. Электролитами являются растворимые кислоты, щелочи, соли.
Неэлектролиты — вещества, растворы (и расплавы) которых не проводят электрический ток. Неэлектролитами являeтся большинство органических веществ.
Электролитическая диссоциация — распад электролита на ионы под действием полярных молекул растворителя.
Основы теории электролитической диссоциации – С.Аррениус:
1. Электролиты при растворении в воде диссоциируют на ионы.
2. Под действием электрического тока ионы движутся в растворе: положительно заряженные (катионы) - к катоду, отрицательно заряженные (анионы) - к аноду.
3. Диссоциация – обратимый процесс.
Степень диссоциации α — отношение числа распавшихся молекул к общему числу молекул растворенного вещества:
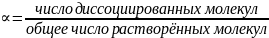
Сильные электролиты диссоциируют нацело, в растворе практически нет молекул, α=1. Примеры: НСl; NaOH; KBr.
Слабые электролиты диссоциируют на ионы лишь частично. Следовательно, в растворе устанавливается равновесие между недиссоциированными молекулами и ионами, α<1 . Примеры: H2S; H2O
