
- •Практикум по физической химии
- •Введение
- •1. Термохимия.
- •1.1. Краткая теория.
- •1.2 Экспериментальная часть.
- •1.2.1. Аппаратура
- •1.2.2. Определение постоянной калориметра.
- •1.3. Лабораторная работа 1. Определение теплоты растворения металлического магния Mg в растворе соляной кислоты hCl.
- •Справочная информация.
- •1.4. Лабораторная работа 2. Определение теплоты гидратации сульфата меди CuSo4.
- •2. Термодинамика фазовых переходов.
- •2.1. Краткая теория. Однокомпонентная система.
- •2.2. Лабораторная работа 3. Определение теплоты испарения жидкости динамическим методом
- •3. Гетерогенное химическое равновесие.
- •3.1. Краткая теория
- •1.2. Лабораторная работа 4.
- •Лабораторная работа №4 Гетерогенное химическое равновесие
- •4. Диаграммы состояния двухкомпонентных систем.
- •4.1. Краткая теория.
- •4.2. Лабораторная работа 5. Построение диаграммы состояния бинарной системы фенол-нафталин.
- •5. Электропроводность растворов электролитов.
- •5.1. Краткая теория
- •5.2. Лабораторная работа 6. Электропроводность растворов электролитов.
- •5.3. Лабораторная работа 7. Числа переноса ионов в растворах электролитов.
- •6. Электрохимическое равновесие электрод-электролит
- •6.1. Краткая теория
- •6.2. Лабораторная работа 8. Измерение электродных потенциалов и эдс гальванических элементов.
- •7. Химическая кинетика
- •7.1. Краткая теория
- •7.2. Лабораторная работа 9. Определение скорости реакции омыления уксусноэтилового эфира.
- •7.3. Лабораторная работа 10. Определение скорости реакции инверсии тростникового сахара.
6.2. Лабораторная работа 8. Измерение электродных потенциалов и эдс гальванических элементов.
Цель работы – Измерение ЭДС ячеек, проверка уравнения Нернста.
Аппаратура. Из цинкового, медного и хлор-серебряного электродов составляют соответствующие гальванические элементы. Общая схема ячеек представлена на рис. 6.1 и 6.2. Роль солевого мостика выполняет полоска фильтровальной бумаги, смоченная раствором KCl. Измерение ЭДС гальванических элементов проводится с использованием цифрового вольтметра с высоким внутренним сопротивлением, входящего в состав модуля «Электрохимия» учебно-лабораторного комплекса «Химия».
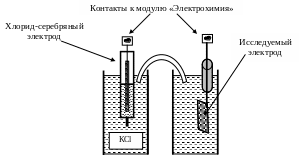
Рис. 6.1. Схема измерительной ячейки с хлорид-серебряным электродом.
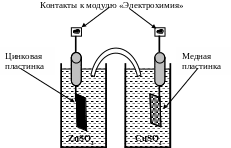
Рис. 6.2. Схема гальванического элемента с медным и цинковым электродами.
Приборы и реактивы
Измерительная система (модули «Электрохимия» и «Универсальный контроллер» учебно-лабораторного комплекса «Химия»);
Медный и цинковый электроды;
Стеклянный электрод;
Хлорид-серебряный электрод стравнения;
Химические стаканы объемом 50 мл – 2 шт;
Полоски фильтровальной бумаги;
Проводники;
1 N растворы CuSO4 и ZnSO4;
0.1 N раствор KCl;
Буферные растворы с известным pH;
Исследуемый раствор с неизвестным pH.
Порядок выполнения работы
Наполняют стаканы растворами ZnSO4 (1 N) и CuSO4 (1 N) опускают в них цинковый и медный электроды соответственно. Третий стакан наполняют 0.1 N раствором KCl. Собирают схему измерения, как показано на рис. 6.1 и 6.2, и производят измерение ЭДС гальванических элементов ZnZnSO4║CuSO4Cu при помощи модуля «Электрохимия» учебно-лабораторного комплекса «Химия». Аналогичное измерение проводят, составив цепь из цинкового (или медного) и хлор-серебряного электродов
Ag, AgClKCl(0.1N)║CuSO4Cu
ZnZnSO4║KCl(0.1N)AgCl, Ag
Результат записывают в таблицу 6.1 и 6.2 (см. ниже).
Используя пипетку, переносят 10 мл раствора СuSO4(1N) в мерную колбу на 100 мл и разбавляют водой до метки. Раствор тщательно перемешивают. Заменив стакан с 1N раствором СuSO4 на 0.1 N, производят измерения ЭДС аналогично тому, как это описано выше. Т.е. измеряют потенциал разбавленного медного электрода относительно неразбавленного цинкового и хлорсеребряного электродов. Далее производят разбавление 0.1N раствора СuSO4 еще в 10 раз и измеряют ЭДС цепи с 0.01N раствором СuSO4 аналогично тому, как это описано выше. Аналогично проводят операции по разбавлению раствора ZnSO4(1N) и измерению его потенциала относительно неразбавленного медного и хлорсеребряного электродов.
Измеренные значения ЭДС сравнивают с теоретически рассчитанными по уравнению Нернста.
Определение рН раствора.
Собирают измерительную цепь как на рис. 6.1, используя стеклянный электрод вместо медного (или цинкового).
Измеряют потенциал стеклянного электрода относительно хлорсеребряного последовательно в двух стандартных буферных растворах с известным pH и строят калибровочный график зависимости потенциала стеклянного электрода от pH раствора.
Измеряют потенциал стеклянного электрода относительно хлорсеребряного в исследуемом растворе, полученном у лаборанта.
По градуировочному графику определяют pH исследуемого раствора. Далее рассчитывают погрешность, зная истинное значение pH раствора.
Таблица 6.1. Результаты измерений и расчетные значения ЭДС элемента Даниэля-Якоби.
Концентрация, г-экв/л |
ЭДС (изм.), В |
ЭДС (расч.), В |
Относительная погрешность измерения, % |
|
CuSO4 |
ZnSO4 |
|||
1 |
1 |
|
|
|
0,1 |
1 |
|
|
|
0,01 |
1 |
|
|
|
1 |
0,1 |
|
|
|
1 |
0,01 |
|
|
|
Оформление результатов.
Результаты лабораторной работы необходимо оформить в виде отчёта в формате Microsoft Word и распечатать. Отчёт должен содержать краткое изложение теоретических основ, хода работы и полученных результатов.
Таблица 6.2. Результаты измерений и расчётные значения ЭДС ячеек с хлорид-серебряным электродом
Концентрация, г-экв/л |
ЭДС (изм.), В |
ЭДС (расч.), В |
Относительная погрешность измерения, % |
CuSO4 |
Ag,AgClKCl(0.1N)║CuSO4Cu |
||
1 |
|
|
|
0,1 |
|
|
|
0,01 |
|
|
|
ZnSO4 |
ZnZnSO4║KCl(0.1N)AgCl,Ag |
||
1 |
|
|
|
0,1 |
|
|
|
0,01 |
|
|
|
Ag,AgClKCl(0.1N)║стеклянный электрод |
|||
|
|
|
|
