
- •Министерство образования российской федерации
- •Предисловие
- •Часть I. Электричество и магнетизм
- •Теоретические сведения
- •§1. Основные детали электрических цепей
- •§2. Классификация электроизмерительных приборов по принципу действия
- •§3.Классификация приборов по роду измеряемого тока
- •§4. Шунты и добавочные сопротивления
- •§5. Снятие показаний с электроизмерительных приборов. Цена деления. Чувствительность приборов
- •§6. Погрешности электроизмерительных приборов
- •§7. Обозначения на шкале приборов
- •§8. Общие требования к выполнению лабораторных работ
- •Контрольные вопросы
- •II. Постоянный электрический ток
- •Законы постоянного тока
- •Упражнение 2 Проверка закона Ома для неоднородного участка
- •Вопросы к допуску
- •Лабораторная работа №2 изучение цепи постоянного тока (виртуальная работа)
- •Вопросы допуска
- •Содержание работы и методика ее выполнения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Методика и порядок измерений
- •Контрольные вопросы
- •III. Переменный электрический ток
- •Содержание работы и методика ее выполнения
- •Определение емкости конденсатора
- •Упражнение 2 Определение индуктивности катушки
- •Порядок выполнения работы
- •К онтрольные вопросы
- •IV. Электрический ток в полупроводниках
- •Лабораторная работа №4
- •Порядок выполнения работы
- •Контрольные вопросы
- •V. Электростатическое полЕ
- •Порядок выполнения работы Упражнение 1 Экспериментальное нахождение эквипотенциальных линий и построение силовых линий
- •Упражнение 2 Определение численных значений напряженности в различных точках электростатического поля
- •Контрольные вопросы
- •VI. Электрический ток в электролитах
- •Первичные и вторичные процессы при электролизе.
- •Лабораторная работа №6 определение электрохимического эквивалента и числа фарадея
- •Вопросы к допуску
- •Содержание работы и методика ее выполнения Порядок выполнения работы
- •Контрольные вопросы
- •VII. Движение заряда в электрическом поле. Осциллограф
- •С хема электронно-лучевой трубки осциллографа
- •Упражнение 1 Определение чувствительности осциллографа
- •Упражнение 2 Определение амплитуды звукового сигнала.
- •Упражнение 3 Изучение фигур Лиссажу.
- •Контрольные вопросы
- •VIII. Магнитное поле земли Теория метода и описание установки
- •Лабораторная работа № 8 определение горизонтальной составляющей напряженности магнитного поля земли
- •Вопросы к допуску
- •Порядок выполнения работы
- •Контрольные вопросы
- •Iх. Движение заряда в магнитном поле лабораторная работа №9 изучение движения заряда в магнитном поле (виртуальная работа)
- •Вопросы к допуску
- •Содержание работы и методика ее выполнения Упражнение 1 Определение отношения заряда частицы к ее массе (q/m)
- •Упражнение 2 Определение шага спирали траектории движения заряженной частицы в магнитном поле
- •Упражнение 3 Изучение принципа работы масс-спектрометра
- •К онтрольные вопросы
- •Приложения
- •Диэлектрическая проницаемость
- •Длины волн и яркости спектральных линии ртути
- •Показатели преломления некоторых веществ
- •Литература
- •Содержание
- •Часть I. Электричество и магнетизм.
- •VIII. Магнитное поле Земли
- •Часть II. Оптика
- •Электричество и магнетизм. Оптика.
Порядок выполнения работы Упражнение 1 Экспериментальное нахождение эквипотенциальных линий и построение силовых линий
Включить выпрямитель. Отметить потенциалы электродов. Согласно теории электроды представляют собой эквипотенциальные поверхности.
Поместить щуп в точку, находящуюся вблизи одного из электродов. Отметить показание вольтметра. Передвигая щуп, найти точки такого же потенциала, нанести их на миллиметровую бумагу и соединить. В результате должна получиться замкнутая линия, заканчивающаяся на стенках кюветы. Это и есть первая эквипотенциальная линия.
Построить 5-7 линий равного потенциала между электродами, отмечая показания вольтметра на каждой линии.
4. Построить силовые линии так, чтобы они были перпендикулярны найденным линиям равного потенциала.
5. Измерения проводить для 2-3 пар электродов по указанию преподавателя.
Упражнение 2 Определение численных значений напряженности в различных точках электростатического поля
Пользуясь формулой (7), найдите напряженность в разных точках электрического поля для различных значений координат х. За начало отсчета (точку х = 0) примите электрод с меньшим потенциалом. Расчет проводите следующимобразом:
а) Выберите значение х1 и определите соответствующее значение потенциала 1.
б) Выберите значение х2 = х1+х, х должно быть не более 0,5 см. Определите соответствующий потенциал 2.
в)
Получите численное значение напряженности
по формуле
![]() Это значение следует отнести к середине
выбранного интервала х.
В этом случае хср
- координата от начала отсчета,
соответствующая вычисленной напряженности
поля.
Это значение следует отнести к середине
выбранного интервала х.
В этом случае хср
- координата от начала отсчета,
соответствующая вычисленной напряженности
поля.
г) Аналогичные расчеты выполнить для 7 - 8 значений координаты х, охватывая весь интервал расстояний между электродами.
д ) Результаты вычислений занести в таблицу.
Таблица
Х 1 |
φ1 |
Х2 |
φ2 |
Е, В/м |
|
|
|
|
|
Постройте графики зависимости φ (х) и Е(х). Соответствуют ли они теоретическим? Если нет, то почему?
Контрольные вопросы
Какими свойствами обладают потенциальные поля, в частности электростатическое поле?
Дайте определение напряженности и потенциала электростатического поля.
Как связаны между собой напряженность и потенциал электростатического поля? Выведите формулу и объясните ее.
Докажите, что линии напряженности ортогональны к эквипотенциальным поверхностям.
VI. Электрический ток в электролитах
Электролиты – жидкие или твердые вещества и системы, в которых присутствуют в заметной концентрации ионы, обусловливающие прохождение по ним электрического тока (ионную проводимость). Электролиты – растворы веществ, молекулы которых распадаются в растворе на ионы. В электролите под влиянием электрического поля молекулы растворителя происходит распад молекул растворенного вещества электролита на отдельные положительно и отрицательно заряженные ионы. Этот процесс называется – электролитической диссоциацией.
По способности к электролитической диссоциации электролиты условно делятся на сильные и слабые.
К
сильным электролитам относятся соли,
некоторые органические кислоты и
основания, к слабым
– многие
органические соли и основания. Степень
диссоциации
![]() зависит от природы растворителя,
температуры, давления и других факторов.
Степенью диссоциации называется
отношение числа диссоциированных
молекул электролита к общему числу его
молекул:
зависит от природы растворителя,
температуры, давления и других факторов.
Степенью диссоциации называется
отношение числа диссоциированных
молекул электролита к общему числу его
молекул:
![]() .
.
При прохождении электрического тока через электролит на опущенных в него электродах происходят окислительно–восстановительные реакции, в результате которых выделяются в свободном виде вещества, входящие в состав электролита. На катоде обычно выделяется химически чистый металл. Вблизи анода выделяется газ.
Электролиз – совокупность электрохимических процессов, проходящих на электродах, погруженных в электролит, при прохождении по нему электрического тока.
Проводимость электролитов – ионная, прохождение тока в них связанно с переносом вещества. На аноде происходит электрохимическое окисление — отрицательно заряженные ионы становятся нейтральными атомами и выделяются из раствора, а на катоде – восстановительная реакция: положительные ионы получают недостающие электроны.
Основные законы электролиза были установлены экспериментально М.Фарадеем в 1833–34 гг.
I закон Фарадея: Масса осевшего на катоде металла прямо пропорциональна количеству электричества прошедшего через электролит: m=kq.
Так как q=It, то согласно 1–му закону Фарадея, масса m выделившегося на катоде вещества прямо пропорциональна времени t прохождения через электролит тока и силе тока I: m=klt.
Коэффициент пропорциональности k называется электрохимическим эквивалентом вещества.
II
закон Фарадея устанавливает связь
электрохимического эквивалента с
химическим эквивалентом:
![]() ,
где
,
где
![]() –
молярная (или атомная) масса,
Z–заряд иона
в единицах абсолютной величины заряда
электрона е:
–
молярная (или атомная) масса,
Z–заряд иона
в единицах абсолютной величины заряда
электрона е:
![]() ,
где
F- постоянная
Фарадея, численно равная заряду, который
должен пройти через электролит, чтобы
на электроде выделилась масса вещества,
численно равная молярной или атомной
массе. Этот заряд переносят ионы,
количество которых в
массе
вещества, численно равной химическому
эквиваленту, составляет
,
где
F- постоянная
Фарадея, численно равная заряду, который
должен пройти через электролит, чтобы
на электроде выделилась масса вещества,
численно равная молярной или атомной
массе. Этот заряд переносят ионы,
количество которых в
массе
вещества, численно равной химическому
эквиваленту, составляет![]() ,где
,где
![]() -число
Авогадро(число
молекул в
1 моль
вещества
=6.022·10
-число
Авогадро(число
молекул в
1 моль
вещества
=6.022·10![]() моль
моль![]() ).
Поэтому
).
Поэтому
![]() ,
где
,
где
![]() - заряд одного иона.
- заряд одного иона.
Так
как заряд одного иона
![]() ,
то
,
то
![]() =96500
Кл/моль.
=96500
Кл/моль.
Электролиз лежит в основе электрохимического метода получения чистых веществ, а также используется для создания тонких слоев одних веществ на поверхности других (никелирование, хромирование и т.д.).
Схема ионной проводимости
Т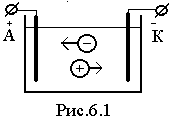 ок
в электролитах представляет
собой движение заряженных атомов и
молекул, т.е. ионов. Под действием
электрического поля положительные ионы
движутся к катоду, а отрицательные ионы
- к аноду.
Положительный ион заимствует у катода
один или несколько электронов и,
нейтрализуясь, выделяется на катоде.
Ионы, выделяющиеся на аноде, т.е. несущие
отрицательный заряд, Фарадей назвал
анионами, а выделяющиеся на катоде
(положительно заряженные) - катионами.
ок
в электролитах представляет
собой движение заряженных атомов и
молекул, т.е. ионов. Под действием
электрического поля положительные ионы
движутся к катоду, а отрицательные ионы
- к аноду.
Положительный ион заимствует у катода
один или несколько электронов и,
нейтрализуясь, выделяется на катоде.
Ионы, выделяющиеся на аноде, т.е. несущие
отрицательный заряд, Фарадей назвал
анионами, а выделяющиеся на катоде
(положительно заряженные) - катионами.
Продукты
разложения электролита выделяются на
электродах все время, пока идет ток, и
их количество можно измерить. Но особенно
легко измерять количество выделяющегося
вещества, если подобрать такой раствор,
при котором выделяющееся вещество
оседает в виде твердого осадка на
электролитах. Так, если пропускать ток
через раствор медного купороса
![]() ,
то на катоде откладывается медь. Это
явление легко наблюдать, если сделать
катод, например, из угля. На черной
поверхности угля ясно заметен красноватый
слой выделившейся меди. Взвешивая катод
до и после опыта, можно точно определить
массу выделившегося металла.
,
то на катоде откладывается медь. Это
явление легко наблюдать, если сделать
катод, например, из угля. На черной
поверхности угля ясно заметен красноватый
слой выделившейся меди. Взвешивая катод
до и после опыта, можно точно определить
массу выделившегося металла.
