
- •1 Загальні відомості та класифікація перетворювачів
- •1.1 Основні поняття та визначення
- •1.2 Класифікація вимірювальних перетворювачів
- •Гальваномагнітні перетворювачі.
- •Електрохімічні перетворювачі.
- •2 Основні фізичні явища у вимірювальних перетворювачах
- •2.1 Ємнісний та п'єзоелектричні ефекти
- •2.2 Електромагнітний та електромеханічний ефекти
- •2.3 Іонізаційний ефект
- •2.4 Зміна опору у вимірювальних перетворювачах
- •2.5 Явище провідності в напівпровідниках
- •2.6 Фотоелектричний ефект
- •2.7 Ефект Холла
- •2.8 Ефект Зеебека
- •Контрольні запитання до 1 та 2 розділів
- •3 Технічні характеристики та структура вимірювальних перетворювачів
- •3.1 Загальна структура вимірювального перетворювача
- •3.3 Структурно – функціональна схема одно функціонального пвп прямого перетворення фізичної величини
- •3.4 Узгодження пвп фізичних величин з еом
- •Контрольні запитання до 3 розділу
- •4 Структурні схеми та чутливі елементи пвп фізичних величин
- •4.1 Чутливі перетворювальні мікроелектронні елементи резистивних пвп
- •4.2 Чутливі перетворювальні мікроелектронні елементи гальваномагнітних пвп
- •4.3 Чутливі перетворювальні елементи оптоелектронних пвп
- •4.4 Чутливі перетворювальні мікроелектронні елементи волоконно – оптичних пвп
- •4.5 Чутливі перетворювальні мікроелектронні елементи з вихідними сигналами у вигляді частоти імпульсів
- •4.6 Чутливі перетворювальні мікроелектронні елементи з цифровими вихідними сигналами
- •5 Вимірювальні кола
- •5.1 Вимірювальні кола генераторних перетворювачів
- •5.2 Вимірювальні кола параметричних перетворювачів
- •5.3 Вимірювальні кола у вигляді незрівноважених мостів
- •Основні властивості мостових незрівноважених кіл:
- •5.4 Вимірювальні кола у вигляді зрівноважених мостів
- •6 Зменшення похибок від впливу паразитних опорів і завад у вимірювальних колах
- •6.1 Вплив опору лінії втрат
- •6.2 Зменшення впливу опорів з’єднувальних проводів і контактів
- •6.3 Зменшення впливу струмів втрат
- •6.4 Термо-ерс і електрохімічна ерс у вимірювальних колах
- •6.5 Захист від впливу магнітних полів
- •6.6 Захист від впливу електричних полів
- •6.7 Завада загального виду
- •Контрольні запитання до 4, 5 та 6 розділів
- •7 Резистивні перетворювачі
- •7.1 Загальні властивості, область застосування резистивних перетворювачів
- •7.1.1 Чутливість резистивного перетворювача і вплив на неї зовнішніх факторів
- •7.2 Реостатні перетворювачі
- •7.3 Тензорезистори
- •7.3.1 Конструкції і технічні характеристики дискретних металічних і напівпровідникових тензорезисторів
- •7.3.2 Конструкції інтегральних напівпровідникових тензорезисторів
- •7.3.3 Область застосування тензорезисторів
- •Контрольні запитання до 7 розділів
- •8 Електростатичні перетворювачі
- •8.1 Принцип дії та область застосування
- •8.2 Зміна ємності під впливом зовнішніх умов
- •8.3 Конструкції ємнісних перетворювачів
- •8.4 Вимірювальні кола ємнісних перетворювачів
- •8.5 Електростатичні перетворювачі в вольтметрах
- •Контрольні запитання до 8 розділу
- •9 П'єзоелектричні перетворювачі
- •9.1 Фізичні основи та область застосування
- •9.2 П’єзоелектричні перетворювачі сили, тиску, прискорення
- •Контрольні запитання до 9 розділу
- •10 Електромагнітні перетворювачі
- •10.1 Принцип дії та область застосування електромагнітних перетворювачів
- •10.2 Двоконтурні електромагнітні перетворювачі
- •10.3 Вимірювальні трансформатори та індуктивні дільники напруги
- •Р исунок 10.4 – Схема Кельвіна–Варлея індукційних дільників наруги
- •10.4 Магнітоелектричні та магнітогідравлічні перетворювачі давачів зрівноваження
- •10.5 Індуктивні та трансформаторні (взаємоіндуктивні) перетворювачі
- •10.6 Магнітопружні та індукційні перетворювачі
- •10.6.1 Індукційні перетворювачі для вимірювання параметрів магнітного поля
- •10.6.2 Індукційні перетворювачі для вимірювання частоти обертання
- •10.6.3 Індукційні перетворювачі параметрів вібрації
- •Контрольні запитання до 10 розділу
- •11 Гальваномагнітні перетворювачі
- •11.1 Перетворювачі Холла
- •11.2 Магніторезистивні перетворювачі
- •11.3 Гальваномагніторекомбінаційні перетворювачі
- •Контрольні запитання до 11 розділу
- •12 Електрохімічні перетворювачі
- •12.1 Загальні теоретичні основи та область застосування
- •12.2 Електрохімічні резистивні перетворювачі
- •12.3 Гальванічні перетворювачі
- •12.4 Кулонометричні перетворювачі
- •12.5 Електрокінетичні перетворювачі
- •12.6 Полярографічні перетворювачі. Іоністори
- •Контрольні запитання до 12 розділу
- •13 Оптоелектричні перетворювачі
- •13.1 Область застосування оптоелектричних перетворювачів
- •13.2 Джерела і приймачі випромінювання
- •13.3 Основні структурні схеми оптоелектричних перетворювачів
- •Контрольні запитання до 13 розділу
- •Список використаної літератури
12.2 Електрохімічні резистивні перетворювачі
Електричний опір комірки електрохімічного перетворювача залежить від складу та концентрації досліджуваного розчину і геометричних розмірів комірки:
![]() (12.1)
(12.1)
де γ – питома електропровідність розчину;
l – відстань між електродами;
S – їх активна площа.
Ця залежність покладена в основу дії електрохімічних резистивних перетворювачів, які широко застосовуються для аналізу складу та концентрації хімічних розчинів, а також перетворювачів переміщення, кута нахилу. В одному випадку при сталих геометричних розмірах комірки вихідний опір перетворювача є функцією питомої провідності розчину (складу та концентрації), в іншому випадку при сталій концентрації розчину – функцією відстані між електродами або їх активної площі. Електрохімічні перетворювачі концентрації бувають контактні (рисунок 12.1) або безконтактні (рисунок 12.2). Похибка перетворення не перевищує 1%.
Безконтактні електрохімічні перетворювачі можуть бути трансформаторними або ємнісними. Трансформаторний перетворювач (рисунок 12.2,а) має чутливий елемент у вигляді вторинної короткозамкненої обмотки, виконаної із скляної трубки, заповненої досліджуваною рідиною.
У високочастотних безконтактних перетворювачах на зовнішню поверхню тонкостінної ізоляції пробірки, наповненої досліджуваним розчином, встановлюють електроди в ємнісних (рисунок 12.2,б) або вимірювальну обмотку в індуктивних (рисунок 12.2,в) перетворювачах.
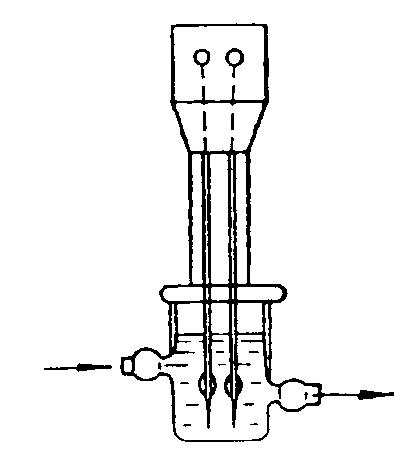
Рисунок 12.1 – Контактний електролітичний перетворювач
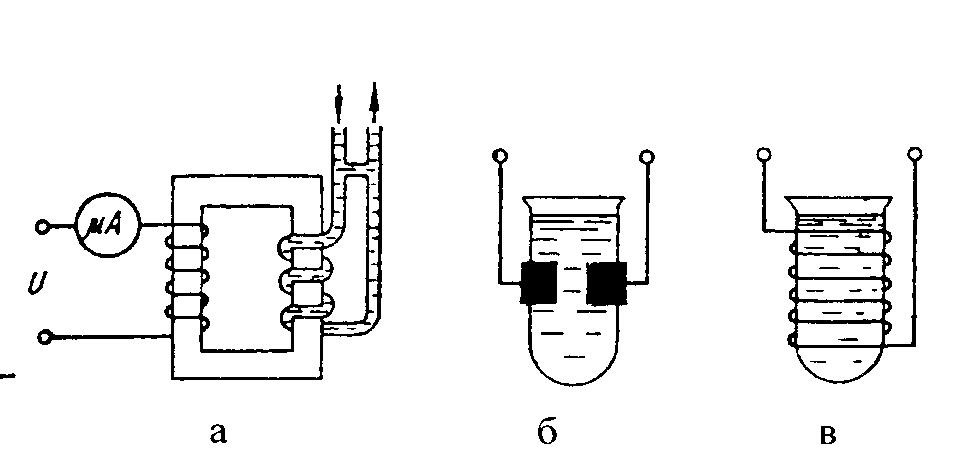
Рисунок 12.2 – Безконтактні електролітичні перетворювачі
Одним із основних джерел похибок є змінна електропровідності розчину під впливом температури.
12.3 Гальванічні перетворювачі
Гальванічні перетворювачі базуються на залежності ЕРС гальванічного кола від концентрації іонів в електроліті і окисно – відновлювальних процесів, які відбуваються на електродах.
Найбільш широке розповсюдження вони отримали в якості рН – метрів.
Принцип дії рН – метрів базується на залежності потенціалів від активності водневих іонів.
Молекули води частково дисоціюють на іони водню та іони гідрооксиду:
Н2О ↔ Н+ + ОН- (12.2)
Цим явищем зумовлена електропровідність води. На практиці для зручності обчислень активність водневих іонів характеризується водневим показником рН, який визначається як від'ємний логарифм активності іонів водню :
![]() . (12.3)
. (12.3)
рН у водних розчинах змінюється від 0 (кислоти) до 14 (луги). У неводних розчинах рН буде іншим.
Гальванічні перетворювачі рН – метра складаються з двох елементів: скляного вимірювального та допоміжного (електродний потенціал якого відомий). Скляний вимірювальний елемент – тонкостінна (0,05.. 0,1мм) колба 1 (рисунок 12.3), нижня сферична частина 2 якої виготовлена із спеціального мембранного скла і заповнена так званою буферною рідиною, тобто розчином із відомим значенням рНо.
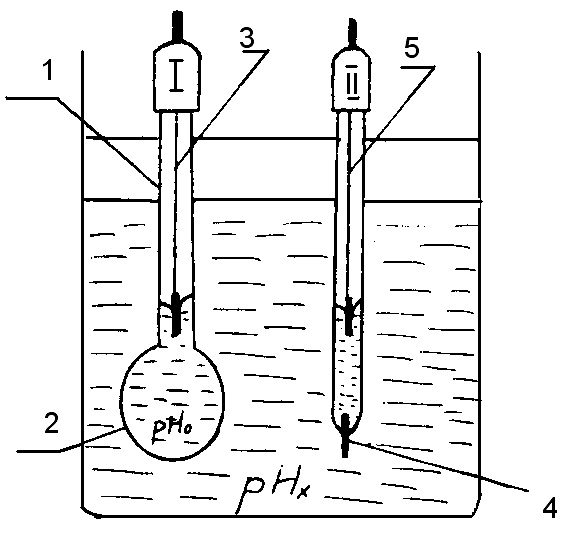
Рисунок 12.3 – Гальванічний перетворювач рН–метр
Всередині колби розміщений хлорсрібний допоміжний електрод 3 (платиновий стержень, покритий шаром хлористого срібла). При зануренні такого елемента в досліджувану рідину на межі скло – розчин виникає електродний потенціал е1, значення якого є функцією рНх. Водночас на внутрішній стінці колби виникає електродний потенціал е2; ще один незалежний від рНх потенціал е3 виникає на хлорсрібному електроді. Отже : е0 = е2+ е3.
ех = е0+ е1= е0+ ерн рНх, (12.4)
Допоміжний елемент може бути розміщений в досліджуваному розчині чи за його межами, але повинен бути з’єднаним з розчином за допомогою відповідної розділювальної мембрани або електролітичного ключа 4 (рисунок 3).
Вихідною величиною гальванічного рН – метра буде:
Е= ех- еД = е0+ ерн рН - еД = Е0 + ерн рН, (12.5)
Основною складовою похибки є температурна, а також дифузійні потенціали.
