- •Фогель ф., Мотульски а. Генетика человека: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1990. – 378 с.
- •Ф. Фогель, а.Мотульски генетика человека
- •4. Действие генов
- •4.1. Развитие менделевской парадигмы
- •4.2. Гены и ферменты
- •4.2.1. Гипотеза «один ген – один фермент»
- •Модель Бидла и Татума. Статья этих исследователей начиналась так:
- •4.2.2. Гены и ферменты у человека: современный уровень знаний
- •4.2.2.1. Обнаружение и анализ ферментативных нарушений
- •4.2.2.2. Типичные нарушения функций ферментов: ферменты эритроцитов
- •4.2.2.3 Мукополисахаридозы
- •4.2.2.5. Влияние кофакторов на активность ферментов [182]
- •4.2.2.6. Сцепленная с х-хромосомой недостаточность гипоксантин-гуанин—фосфорибозилтрансферазы (30800) [7055]
- •4.2.2.7. Фенилкетонурия: пример успешного лечения метаболического заболевания [182; 203]
- •4.2.2.8. Выявление гетерозигот
- •4.2.2.9. Лечение наследственных метаболических заболеваний [1289; 1057; 1058]
- •4.2.2.10. Необнаруженные дефекты ферментов
- •4.3. Гемоглобин человека [119; 31; 97а]
- •4.3.1. История изучения гемоглобина
- •4.3.2. Генетика гемоглобина
- •4.3.4. Талассемии [31; 972; 138; 1253; 222; 97а]
- •4.3.5. Популяциоииая генетика генов гемоглобина (см. [972], разд. 6.1.2.3)
- •4.3.6. Пренатальная диагностика гемоглобинопатии [966; 2269; 2322; 2361]
- •4.4. Генетика антител и системы антиген/рецептор
- •4.5. Фармакогенетика и экогенетика 4.5.1. Фармакогенетика
- •4.5.2. Экогенетика [143; 969; 1228; 1250]
- •4.6. Механизм аутосомной доминантности
- •4.6.1. Аномальная агрегация субъединиц
- •4.6.2. Аномальные субъединицы нарушают функции мультимерных белков
- •4.6.3. Аномальное ингибирование ферментов по типу обратной связи и структурно аномальные ферменты
- •4.6.4. Мутации рецепторов
- •4.6.5. Наследственные дефекты клеточных мембран
- •4.6.6. Накопление аномальных фибриллярных белков: наследственные амилоидозы (10480 10525) [1102]
- •4.6.7. Доминантно наследуемые опухолевые заболевания
- •4.7. Генетика эмбрионального развития
- •4.7.1. Активность генов в раннем развитии
- •4.7.2. Поздние стадии эмбрионального развития; фенокопии
- •4.7.3. Регуляция активности генов у бактерий и эукариот
- •4.7.4. Соотношения генотипа и фенотипа при хромосомных аберрациях у человека [1176]
- •4.7.4.1. Эффект дозы генов при трисомиях и картирование генов
- •4.7.4.2. Другие биохимические аномалии при хромосомных аберрациях
- •4.7.4.3. Изучение хромосомных аберраций на уровне клеток
- •4.7.5. Определение поля
- •5. Мутации
- •5.1. Спонтанные мутации
- •5.1.1. Генетические изменения, обусловленные мутациями de novo
- •5.1.2. Геномные и хромосомные мутации у человека
- •5.1.2.1. Частота возникновения мутаций (скорость мутирования)
- •5.1.2.2. Нерасхождение хромосом и возраст матери
- •5.1.2.3. У какого пола и в каком из мейотических делений происходит нерасхождение хромосом?
- •5.1.2.4. Нерасхождение, хромосомные варианты и сателлитные ассоциации
- •5.1.3. Генные мутации: анализ на фенотипическом уровне
- •5.1.3.1. Методы оценки частот мутаций
- •5.1.3.2. Результаты оценки частот мутаций
- •5.1.3.3. Частота мутаций и возраст отца
- •5.1.3.4. Возможные различия частот возникновения мутаций у индивидов разного пола
- •182 5. Мутации
- •5.1.3.5. Герминативноклеточные и соматоклеточные мозаики по доминантным и х-сцепленным мутациям
- •5.1.4. Генные мутации: анализ на молекулярном уровне
- •5.1.4.1. Частоты кодонных мутаций
- •5.1.4.2. Проблема оценки общей частоты мутаций на геном и на поколение
- •5.1.4.3. Мутации в гемоглобиновых генах и генетический код
- •5.1.4.4. Мутации у микроорганизмов: их вклад в понимание механизма мутаций у человека
- •5.1.5. Изучение генных мутаций в отдельных клетках
- •5.1.6. Соматические мутации
- •5.1.6.1. Образование мозаиков по геномным мутациям
- •5.1.6.2. Наследственные синдромы с повышенной нестабильностью хромосом [1465; 1464; 1634]
- •5.1.6.3. Молекулярные механизмы хромосомной нестабильности и образование опухоли, обусловленное соматической мутацией
- •5.1.6.4. Другие факты, свидетельствующие о роли соматической мутации в механизме канцерогенеза [1520]
- •5.1.6.5. Онкогены [1686; 1690, 1691, 1696}
- •5.1.6.6. Рак у человека с точки зрения генетики
- •5.1.6.7. Соматические мутации и старение
- •5.2. Мутации, индуцированные облучением и химическими мутагенами
- •5.2.1. Мутации, индуцированные радиацией
- •5.2.1.1. Основные факты и проблемы, поставленные в ходе их анализа
- •5.2.1.2. Проблема оценки генетического риска, обусловленного радиацией и другими мутагенными факторами окружающей среды
- •5.2.1.3. Результаты изучения мутагенного действия радиации на млекопитающих [1377]
- •5.2.1.4. Облучение популяции человека ионизирующей радиацией
- •5.2.1.5. Насколько может увеличиться частота возникновения спонтанных мутаций9
- •Данные о соматических хромосомных мутациях, возникающих под воздействием радиации.
- •5.2.2. Химически индуцированные (мутации)
- •5.2.2.1. Суть проблемы
- •5.2.2.2. Исследовательские стратегии при оценке генетического риска, обусловленного химическими мутагенами
- •5.2.2.3. Каким образом химические мутагены действуют на генетический материал?
- •5.2.2.4. Насколько широким является воздействие агента на человеческую популяцию?
- •5.2.2.5. Какого увеличения частоты спонтанных мутаций, обусловленного химическими мутагенами, следует ожидать?
- •6. Популяционная генетика
- •6.1. Описание популяций
- •6.1.1. Закон Харди—Вайнберга: генные частоты
- •6.1.2. Генетический полиморфизм
- •6.1.3. Наследственные болезни
- •6.2. Систематические изменения генных частот: мутации и отбор
- •6.2.1. Естественный отбор
- •6.2.1.1. Математические модели отбора: дарвиновская приспособленность
- •6.2.1.2. Отбор, приводящий к изменению генных частот в одном направлении
- •6.2.1.3. Отбор, приводящий к генетическому равновесию
- •6.2.1.4. Отбор, приводящий к нестабильному равновесию
- •6.2.1.5. Другие формулы отбора
- •6.2.1.6. Отбор, обусловленный инфекционными болезнями [1831; 211]
- •История некоторых инфекционных заболеваний.
- •6.2.1.7. Естественный отбор и история популяций: НbЕ и β-талассемия 1)
- •6.2.1.8. Отбор по системе групп крови аво и другим полиморфным системам
- •6.3. Отклонение от случайного скрещивания
- •6.3.1. Кровнородственные браки
- •6.3.1.1. Коэффициент инбридинга [103]
- •6.3.1.2. Инбридинг, размер изолята и наследственные заболевания
- •6.3.2. Концепция генетического груза
- •6.3.2.1. Теория
- •6.3.2.2. Практическое применение теории
- •6.3.2.3. Критическая оценка
- •6.3.2.4. Более прямые подходы к оценке числа рецессивных генов на индивид
- •6.3.3. Дифференциация субпопуляций: генетическое расстояние
- •6.3.4. Поток генов
- •6.4. Случайные флуктуации генных частот
- •6.4.1. Генетический дрейф
- •6.4.2. Генетический дрейф в сочетании с мутационным процессом и отбором
- •Оглавление
- •Глава 4 Действие генов 5
- •Глава 5. Мутации 142
- •Глава 6. Популяционная генетика 278
- •Электронное оглавление
- •4. Действие генов 5
- •4.1. Развитие менделевской парадигмы 5
- •4.2. Гены и ферменты 8
- •4.7. Генетика эмбрионального развития 126
- •5. Мутации 142
- •5.1. Спонтанные мутации 142
- •5.2. Мутации, индуцированные облучением и химическими мутагенами 222
- •6. Популяционная генетика 278
- •6.1. Описание популяций 279
- •6.2. Систематические изменения генных частот: мутации и отбор 294
- •6.3. Отклонение от случайного скрещивания 339
- •6.4. Случайные флуктуации генных частот 367
4.3.5. Популяциоииая генетика генов гемоглобина (см. [972], разд. 6.1.2.3)
Обнаруженный в локусе Hbβ полиморфизм позволяет проследить возникновение и распространение различных гемоглобинопатии. Можно предположить, что мутация «гемоглобин S» возникла независимо в трех различных географических зонах (Сенегал, Бенин, Банту) и затем широко распространилась благодаря селективному преимуществу, которое она дает против заболевания малярией [1833]. Среди хромосом с мутацией НbЕ в Юго-Восточной Азии различают три гаплотипа, один из которых возникает в результате кроссинговера в «горячей точке» (см. выше). Мутация «гемоглобин С» сцеплена, как правило, с одним гаплотипом (см., однако, разд. 6.2.1.6). Отдельные мутации, приводящие к β-талассемии, обычно возникают в уникальных гаплотипах и затем распространяются благодаря селекции на устойчивость к малярии. Из 31 точковой мутации, приводящей к β-талассемии, лишь 2 встречаются более чем у одной этнической группы. Связь конкретной мутации со специфическим гаплотипом в значительной степени облегчила установление природы различных мутаций, вызывающих талассемию. Поскольку для исследования были выбраны различные гаплотипы ДНК, существовала вероятность обнаружения новых, ранее неизвестных мутаций. И действительно, удалось открыть много новых типов талассемии [1253]. Можно заключить, что все распространенные талассемии и гемоглобинопатии возникли уже после дивергенции человеческих рас и в большинстве случаев остаются сцепленными с хромосомами, в которых они впервые появились. Если одна и та же мутация сцеплена с разными гаплотипами, это в большинстве случаев проще всего объяснить мейотическим кроссинговером в «горячей точке» рекомбинации, расположенной перед геном β-глобина.
Большой интерес вызывает возможность межаллельной конверсии. Так, мутация Нbβ39 на острове Сардиния сцеплена с несколькими гаплотипами, что трудно объяснить простой рекомбинацией. Более вероятным механизмом считается однонаправленный перенос генетической информации, или конверсия (рис. 2.97). Этот же механизм предполагают для объяснения подобных данных по мутациям гемоглобин S, гемоглобин Е и мутации сдвига рамки в гене β-глобина. Такой механизм представляется очень привлекательным, поскольку имеются убедительные доказательства генной конверсии в эволюции генов глобинов у нечеловекообразных обезьян. Высказываются предположения о молекулярных механизмах такой конверсии [972]. Для шести хорошо изученных мутаций в интронах, которые приводят к талассемии, признаков генной конверсии не обнаружено.
4.3.6. Пренатальная диагностика гемоглобинопатии [966; 2269; 2322; 2361]
Существует несколько возможных подходов к пренатальной диагностике гемо-
4. Действие генов 99
|
|
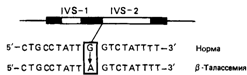
Рис. 4.59, Олигонуклеотидный зонд (олигонуклеотид из 19 остатков) для гена нормального β-глобина отличается от зонда для гена с мутацией, приводящей к β -талассемии только заменой G А в интроне IVS-2. В соответствующих условиях гибридизации зонд для мутантного гена будет узнавать только мутантный ген, но не нормальный. Аналогичным образом «нормальный зонд» не будет гибридизоваться с мутантным геном. |
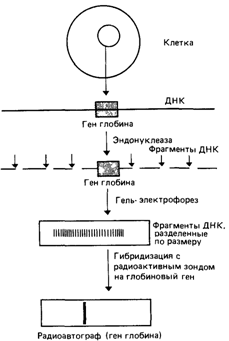
Рис. 4.60. Обнаружение глобинового гена. ДНК выделяют из любого препарата клеточных ядер, в ее составе имеются глобиновые гены. Различные рестрикционные эндонуклеазы (рестриктазы) расщепляют ДНК на множество фрагментов (рестриктов), узнавая специфические последовательности нуклеотидов. Фрагменты разделяют по размеру с помощью гель-электрофореза. Готовят специфический радиоактивный зонд на глобиновый ген и гибридизуют его с фрагментами ДНК Радиоактивный сигнал обнаруживают с помощью радиоавтографии [1252]. |
глобинопатий: а) биохимический анализ гемоглобина на уровне белка в образцах крови, получаемых при фетоскопии или пункции плаценты; б) амниоцентез (пункция амниотической жидкости) на 15-16-й неделе с последующим анализом ДНК амниотических клеток; в) анализ ДНК ворсинок хориона, полученных при биопсии хориона на 9-10-й неделе беременности (разд. 9.1.1). В прямой диагностике клеток и тканей плода используются рестрикционные эндонуклеазы (рестриктазы), позволяющие распознать специфические мутации, например гемоглобин S, а также олигонуклеотидные зонды [1254; 2376], способные гибридизоваться с ДНК при конкретной мутации, вызывающей талассемию (рис. 4.59). В основе косвенных методов пренатальной диагностики лежит семейный анализ рестрикционных сайтов ДНК (выявляемых при анализе полиморфизма длины рестрикционных фрагментов), тесно сцепленных с изучаемой формой талассемии (разд. 9.1.1).
Все эти методы были использованы к настоящему моменту. Взятие образцов крови при фетоскопии или пункции плаценты во многих случаях приводит к гибели плода (5% у опытных специалистов), хотя сам анализ относительно прост: для крови, взятой непосредственно у плода, достаточно методов исследования белков. По мере усовершенствования и упрощения методов молекулярной биологии (рис. 4.60) все большее число лабораторий переключается на их использование. Биопсия хориона имеет некоторые преимущества перед амниоцентезом: при этом удается получить больше ДНК, на более ранних сроках, меньше времени требуется для окончательного заключения. После амниоцентеза для получения биомассы, необходимой для анализа ДНК, клетки приходится культивировать в течение нескольких недель.
Методы прямого анализа ДНК всегда более предпочтительны, поскольку не связаны с изучением семей. Так, в диагностике талассемии большие надежды возлагают на применение специфических олигонуклеотидных зондов и разработку методов гибридизации без использования радиоактивной метки. Однако при этом заранее необходимо предполагать, какой именно му-
100 4. Действие генов
тации, приводящей к талассемии, следует ожидать. В этом могут помочь данные по сцеплению конкретной мутации со специфическим гаплотипом ДНК. Таким образом, для установления природы мутации, вызывающей талассемию, требуется предварительное исследование ДНК больного родственника.
Гемоглобин как модельная система. Гемоглобин - наиболее изученная генетическая система у человека. На основе концепций, разработанных в ходе ее изучения, можно глубже понять другие явления в генетике человека. Например, если в разных семьях обнаруживаются наследственные заболевания с различным фенотипическим проявлением, обычно заключают, что они вызваны мутациями в разных генах. Исследования гемоглобина показывают, что так бывает не всегда. Например, хотя метгемоглобинемия фенотипически сильно отличается от гемолитической анемии или эритроцитоза, причиной их являются аллельные мутации. Таким образом, фенотип определяется тем, какая именно молекулярная аномалия лежит в его основе и каким образом при этом изменена нормальная функция.
Другой полезный урок можно извлечь из того, как тетрамерная структура гемоглобина обеспечивает функцию связывания кислорода, а также как мутации могут влиять на эту функцию, нарушая взаимодействие различных глобиновых цепей. Хотя большинство мутаций, изменяющих гемоглобин, нейтральны, все патологические варианты, за исключением серповидноклеточной анемии, наследуются по доминантному типу. Отсюда следует, что один из возможных механизмов доминирования заключается в нарушении взаимодействия между продуктами аллельных генов (разд. 4.6).
Наконец, изучение гемоглобинов продемонстрировало многообразие механизмов возникновения мутаций у человека. Они могут затрагивать как структурные гены, так и прилегающие регуляторные участки. В большинстве случаев - это замены нуклеотидов, но встречаются и делеции, которые могут сильно различаться по длине. Хотя у прокариот мутации со сдвигом рамки считывания широко распространены, их обнаружение у человека было несколько неожиданным для специалистов. Наше представление о роли мутаций в эволюции во многом основано на результатах изучения мутаций гемоглобина.