
- •Введение техническая термодинамика как теоретическая основа теплоэнергетики
- •1. Общие определения и понятия
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры состояния
- •Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.3.2. Уравнение состояния термодинамической системы
- •1.3.3. Термические коэффициенты
- •1.3.4. Термодинамический процесс
- •2. Первый закон термодинамики для закрытой системы
- •2.1. Работа изменения объема
- •2.2. Теплота, теплоемкость, энтропия
- •2.3. Внутренняя энергия
- •2.4. Первый закон термодинамики для закрытой системы
- •2.4.1. Аналитические выражения первого закона термодинамики.
- •2.4.2. Энтальпия
- •3. Газы и газовые смеси
- •3.1. Законы идеальных газов
- •3.1.1. Внутренняя энергия идеального газа
- •3.1.2. Теплоемкости газов
- •Удельные теплоемкости
- •Теплоемкости процессов
- •Теплоемкости идеальных газов
- •Теплоемкость реальных газов
- •Отношение изобарной и изохорной теплоемкостей
- •3.1.3. Энтальпия идеальных газов
- •3.1.4. Энтропия идеальных газов
- •3.2. Газовые смеси
- •Основные характеристики смеси газов
- •Теплоемкости газовых смесей
- •4. Газовые процессы
- •4.1. Политропные процессы
- •4.2. Частные случаи политропных процессов
- •Уравнения процессов, расчетные выражения их теплоты, работы, изменения внутренней энерги, энтальпии и энтропи
- •4.3. Изображение политропных процессов в р,V и t,s- диаграммах Политропа в р,V- диаграмме
- •Политропа в t,s- диаграмме
- •4.4. Установление показателя политропы по опытным данным
- •4.5. Качественный и количественный анализ политропных процессов в р,V- и t,s- диаграммах
- •4.6. Определение термодинамических свойств идеальных газов с учетом влияния температуры на их изобарную и изохорную теплоемкости
- •Определение энергетических параметров идеальных газов с учетом влияния температуры на cp и cv
4.4. Установление показателя политропы по опытным данным
Все, что было изложено ранее относительно политропных процессов, применимо к идеальным газам с постоянной изохорной теплоемкостью – сv. Для реальных газов изохорная теплоемкость величина переменная, следовательно, политропному процессу реального газа, отвечающему соотношению du/q==const, будет соответствовать переменная теплоемкость с=сv/. Переменная величина теплоемкости политропного процесса реального газа приводит к сложным зависимостям между термическими и энергетическими параметрами газа в таких процессах. Однако с достаточной для технических расчетов степенью точности для реальных газов можно использовать большинство полученных ранее формул для политропного процесса идеального газа [8], понимая при этом под политропным процессом реального газа процесс, удовлетворяющий уравнению
Pvn=const.
Величина показателя политропы n считается постоянной. Для уменьшения погрешности расчетов изохорную теплоемкость сv берут как среднюю cvm в интервале температур рассматриваемого процесса. Используя среднюю изохорную теплоемкость реального газа, можно приближенно рассчитать показатель политропы n. По заданной величине определяют среднее значение теплоемкости политропного процесса на данном интервале температур как сm=сvm/, и по этой теплоемкости рассчитывается показатель политропы:
 ,
(a)
,
(a)
где срm=cvm+R.
При экспериментальном исследовании процессов изменения состояния газов получают опытные данные серии мгновенных значений термических параметров в виде графического или цифрового материала. Для проведения термодинамического анализа таких процессов необходимо установить, являются ли они политропными. В случае, если процесс соответствует политропному процессу, необходимо определить показатель политропы n. Если весь процесс не может рассматриваться как политропный, то он может быть разделен на участки, которые с достаточной степенью точности могут рассматриваться как политропные, и для каждого из этих участков определяется свое среднее значение показателя политропы n.
Рассмотрим некоторые из методов обработки и анализа опытных данных закономерных газовых процессов.
Оценить, относится газовый процесс к политропному или нет, наиболее просто, изобразив его в логарифмических координатах LnP–Lnv. Прологарифмировав уравнение политропы Pvn=const, получим уравнение
LnP + nLnv = A. (б)
В логарифмической системе координат LnP–Lnv это уравнение прямой линии. Следовательно, нанеся опытные точки процесса в данной системе координат, можно сделать вывод, относится ли данный процесс к политропному. Если все опытные точки ложатся на одну прямую (рис.4.9), то процесс подчиняется уравнению политропы Pvn=const. Если точки не ложатся на одну прямую, то это не политропный процесс. Однако в этом случае может быть проведена аппроксимация опытных точек с заменой действительного процесса политропным. Оценить пригодность такой политропы для расчетов процесса с заданной степенью точности можно по отклонению опытных точек от политропы.
Д ля
политропного процесса, изображенного
в виде прямой в системе координат
LnP–Lnv,
показатель политропы легко определяется
из уравнения (б) в виде углового
коэффициента, который можно выразить
через отношение отезков (см. рис.4.9):
ля
политропного процесса, изображенного
в виде прямой в системе координат
LnP–Lnv,
показатель политропы легко определяется
из уравнения (б) в виде углового
коэффициента, который можно выразить
через отношение отезков (см. рис.4.9):
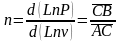 .
(в)
.
(в)
На рис.4.10 изображены политропные процессы в логарифмической системе координат с различными показателями политропы: n=0 – изобара, n=1 – изотерма, n=к – адиабата, n= – изохора.
Определить показатель политропы можно и по параметрам двух точек процесса. В случае если процесс соответствует политропе, для двух его точек можно записать равенство
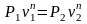 или
или
 .
.
Прологарифмировав полученное равенство, получим расчетное выражение для показателя политропы:
 ,
,
 .
(г)
.
(г)
