
- •Введение техническая термодинамика как теоретическая основа теплоэнергетики
- •1. Общие определения и понятия
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры состояния
- •Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.3.2. Уравнение состояния термодинамической системы
- •1.3.3. Термические коэффициенты
- •1.3.4. Термодинамический процесс
- •2. Первый закон термодинамики для закрытой системы
- •2.1. Работа изменения объема
- •2.2. Теплота, теплоемкость, энтропия
- •2.3. Внутренняя энергия
- •2.4. Первый закон термодинамики для закрытой системы
- •2.4.1. Аналитические выражения первого закона термодинамики.
- •2.4.2. Энтальпия
- •3. Газы и газовые смеси
- •3.1. Законы идеальных газов
- •3.1.1. Внутренняя энергия идеального газа
- •3.1.2. Теплоемкости газов
- •Удельные теплоемкости
- •Теплоемкости процессов
- •Теплоемкости идеальных газов
- •Теплоемкость реальных газов
- •Отношение изобарной и изохорной теплоемкостей
- •3.1.3. Энтальпия идеальных газов
- •3.1.4. Энтропия идеальных газов
- •3.2. Газовые смеси
- •Основные характеристики смеси газов
- •Теплоемкости газовых смесей
- •4. Газовые процессы
- •4.1. Политропные процессы
- •4.2. Частные случаи политропных процессов
- •Уравнения процессов, расчетные выражения их теплоты, работы, изменения внутренней энерги, энтальпии и энтропи
- •4.3. Изображение политропных процессов в р,V и t,s- диаграммах Политропа в р,V- диаграмме
- •Политропа в t,s- диаграмме
- •4.4. Установление показателя политропы по опытным данным
- •4.5. Качественный и количественный анализ политропных процессов в р,V- и t,s- диаграммах
- •4.6. Определение термодинамических свойств идеальных газов с учетом влияния температуры на их изобарную и изохорную теплоемкости
- •Определение энергетических параметров идеальных газов с учетом влияния температуры на cp и cv
4.1. Политропные процессы
В переводе на русский язык слово «политропный» означает закономерный. Закономерность энергетических взаимодействий приведет к закономерному изменению членов первого закона термодинамики для данного тела. В случае обратимого (без трения) процесса соблюдается первый закон термодинамики q=du+. Для закономерного процесса имеется определенное соотношение между членами уравнения первого закона термодинамики. Обычно за величину, определяющую закономерность энергетического взаимодействия, принимают отношение изменения внутренней энергии к количеству подведенной теплоты:
= du/q . (4.1)
Действительно, в случае постоянства =const получается, что все члены первого закона термодинамики будут находиться в строгом соотношении друг с другом, определяемом величиной :
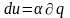 ,
,
 ,
,
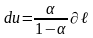 ,
,
 .
(4.2)
.
(4.2)
Процессы, подчиняющиеся закономерному энергетическому взаимодействию, при котором = du/q = const, называются политропными.
Рассмотрим обратимый (без трения) закономерный (политропный) процесс применительно к идеальному газу.
Для идеальных газов с постоянными изобарными и изохорными теплоемкостями политропный процесс будет характеризоваться следующими соотношениями:
du = cvdT = q = cdT .
Поскольку cv=const и =const, то и теплоемкость политропного процесса для идеального газа будет величиной постоянной:
c = cv/ = const . (4.3)
Постоянство теплоемкости определяет закономерность изменения параметров в политропном процессе. Для определения этой закономерности воспользуемся двумя уравнениями первого закона термодинамики:
q=cdT=dh-vdp=cpdT-vdp;
q=cdT=du+pdv=cvdT+pdv.
Преобразуем эти уравнения, переместив члены с теплоемкостями в левую часть:
(c-cp)dT = - vdp,
(c-cv)dT = pdv .
После деления правых и левых частей равенств друг на друга получим постоянную величину
 .
(4.4)
.
(4.4)
Обозначим левую часть равенства буквой n:
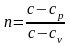 .
(4.5)
.
(4.5)
Эта постоянная величина n получила название показателя политропы.
Подставив показатель политропы в выражение (4.4) и сделав элементарные преобразования, получим соотношение
npdv = - vdp или npdv + vdp = 0 .
Разделив последнее равенство на произведение pv, получим
ndv/v + dP/P = 0 .
После интегрирования последнего равенства получаем

или окончательно
Рvn = const . (4.6)
Уравнение (4.6) называется уравнением политропы. Оно описывает закономерность изменения параметров в политропном процессе. В выражении (4.6) дана взаимосвязь двух термических параметров P и v. Поскольку состояние идеального газа подчиняется уравнению Pv=RT, то, выразив Р и v через соответствующую пару термических параметров v, Т и Р, Т и подставив их поочередно в выражение (4.6), получим уравнения политропы, описывающие взаимосвязь параметров v, Т и Р, Т:
 ;
(4.7)
;
(4.7)
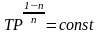 .
(4.8)
.
(4.8)
Политропа в системе координат P-v-T представляет собой кривую, проекции которой на оси P-v, T-v, T-P описываются уравнениями (4.6), (4.7), (4.8). Константы этих уравнений определяются по любой паре термических параметров для одной из точек (любой), находящейся на этой политропе. Таким образом, политропа считается заданной, если известны ее параметры хотя бы в одной точке и задан показатель политропы n.
П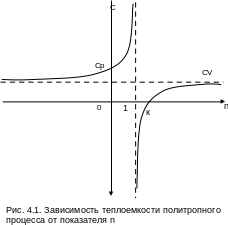 ри
одинаковых показателях политропы n
константы в выражениях (4.6), (4.7), (4.8) для
различных политроп будут иметь различные
значения. Такие политропы имеют одинаковую
закономерность изменения параметров
и в системе координат термических
параметров состояния не пересекаются.
ри
одинаковых показателях политропы n
константы в выражениях (4.6), (4.7), (4.8) для
различных политроп будут иметь различные
значения. Такие политропы имеют одинаковую
закономерность изменения параметров
и в системе координат термических
параметров состояния не пересекаются.
Расчетное выражение для теплоемкости политропного процесса получается из уравнения (4.5):
 ,
,
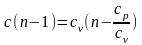 ,
,
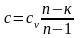 .
(4.9)
.
(4.9)
Показатель политропы может иметь численные значения от - до +. В соответствии с уравнением (4.9) теплоемкость политропных процессов в зависимости от n также может принимать значения от - до +. Функциональная зависимость теплоемкости политропного процесса от n приведена на рис.4.1.
Используя уравнение (4.9), получим расчетное выражение для константы в политропном процессе:
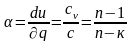 .
(4.10)
.
(4.10)
В политропном процессе при изменении параметров идеального газа от точки 1 до точки 2 изменение внутренней энергии, энтальпии и энтропии определяется по уравнениям
u2 - u1 = cv(T2 - T1); (4.11)
h2 - h1 = cp(T2 - T1); (4.12)
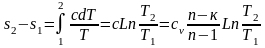 .
(4.13)
.
(4.13)
Изменение энтропии можно рассчитать по изменению любого термического параметра, а не только по изменению температуры. Для этого достоточно воспользоваться уравнениями (4.7) и (4.8):
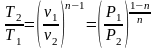 .
(4.14)
.
(4.14)
Расчет теплоты в политропном процессе целесообразно вести по следующей зависимости:
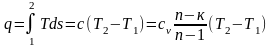 .
(4.15)
.
(4.15)
Работа в политропном процессе может быть определена как интеграл или из первого закона термодинамики:
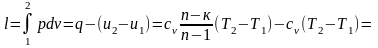
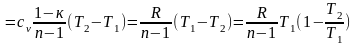 .
(4.16)
.
(4.16)
Используя выражение (4.16), можно определить работу, зная изменение любого параметра. Для этого отношение температур необходимо выразить через отношение объемов или давлений в соответствии с выражениями (4.14).
