
- •Введение техническая термодинамика как теоретическая основа теплоэнергетики
- •1. Общие определения и понятия
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры состояния
- •Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.3.2. Уравнение состояния термодинамической системы
- •1.3.3. Термические коэффициенты
- •1.3.4. Термодинамический процесс
- •2. Первый закон термодинамики для закрытой системы
- •2.1. Работа изменения объема
- •2.2. Теплота, теплоемкость, энтропия
- •2.3. Внутренняя энергия
- •2.4. Первый закон термодинамики для закрытой системы
- •2.4.1. Аналитические выражения первого закона термодинамики.
- •2.4.2. Энтальпия
- •3. Газы и газовые смеси
- •3.1. Законы идеальных газов
- •3.1.1. Внутренняя энергия идеального газа
- •3.1.2. Теплоемкости газов
- •Удельные теплоемкости
- •Теплоемкости процессов
- •Теплоемкости идеальных газов
- •Теплоемкость реальных газов
- •Отношение изобарной и изохорной теплоемкостей
- •3.1.3. Энтальпия идеальных газов
- •3.1.4. Энтропия идеальных газов
- •3.2. Газовые смеси
- •Основные характеристики смеси газов
- •Теплоемкости газовых смесей
- •4. Газовые процессы
- •4.1. Политропные процессы
- •4.2. Частные случаи политропных процессов
- •Уравнения процессов, расчетные выражения их теплоты, работы, изменения внутренней энерги, энтальпии и энтропи
- •4.3. Изображение политропных процессов в р,V и t,s- диаграммах Политропа в р,V- диаграмме
- •Политропа в t,s- диаграмме
- •4.4. Установление показателя политропы по опытным данным
- •4.5. Качественный и количественный анализ политропных процессов в р,V- и t,s- диаграммах
- •4.6. Определение термодинамических свойств идеальных газов с учетом влияния температуры на их изобарную и изохорную теплоемкости
- •Определение энергетических параметров идеальных газов с учетом влияния температуры на cp и cv
Теплоемкость реальных газов
Для реальных газов теплоемкости cv и сp зависят от давления и температуры газа. Это обусловлено наличием сил межмолекулярного взаимодействия, изменением взаимного положения атомов в молекулах (молекулы двух - и многоатомных газов не жесткие, присутствует колебательное движение атомов в молекуле) и неравномерным распределением внутренней энергии по степеням свободы в зависимости от изменения температуры и давления газа.
З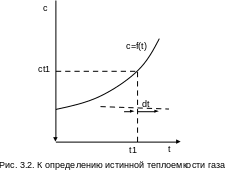 ависимость
теплоемкости газов от давления в большей
степени проявляется в состоянии газов,
близком к области насыщения (см. разд.
6). Для газов, состояние которых далеко
от области насыщения, зависимость
теплоемкости от давления незначительна
и при практических расчетах ею
пренебрегают. Зависимость от температуры
очень существенна, ей пренебрегать при
точных расчетах нельзя.
ависимость
теплоемкости газов от давления в большей
степени проявляется в состоянии газов,
близком к области насыщения (см. разд.
6). Для газов, состояние которых далеко
от области насыщения, зависимость
теплоемкости от давления незначительна
и при практических расчетах ею
пренебрегают. Зависимость от температуры
очень существенна, ей пренебрегать при
точных расчетах нельзя.
Аналитическое выражение этой зависимости весьма сложное и требует нахождения целого ряда экспериментальных констант для каждого газа. Практическое определение теплоемкостей сv и сp реальных газов ведется экспериментально. В соответствии с этим были введены понятия истинной и средней теплоемкости газа.
Истинная теплоемкость газа соответствует расчетному выражению
 ,
(3.35)
,
(3.35)
она определяется как частное от деления элементарной теплоты процесса на элементарное изменение его температуры относительно точки процесса с фиксированной температурой (рис.3.2). Для реальных газов каждому значению температуры процесса соответствует вполне определенное значение истинной теплоемкости.
Экспериментальная зависимость истинной теплоемкости процесса реального газа от температуры обычно представляется в виде степенного полинома графика (см. рис.3.2) или табличного численного материала.
с = а + b1t + b2t2 + b3t3 + + bntn . (3.36)
Определение теплоты с помощью истинной теплоемкости ведется интегрированием:
 .
(3.37)
.
(3.37)
Теплота q12 на рис.3.3 соответствует площади под процессом 12. Средняя теплоемкость газа соответствует расчетному выражению
 ,
(3.38)
,
(3.38)
она определяется как теплота процесса, идущего в интервале температур t1 и t2, деленная на разность этих температур (рис.3.3).
Средней теплоемкостью можно пользоваться только на данном интервале температур. Это очень неудобно, т.к. для практических расчетов необходимо в таблицах экспериментальных данных по средним теплоемкостям предусмотреть все возможные температурные интервалы. Выход из этой ситуации был найден введением средней теплоемкости, определенной от одинаковой начальной температуры. В качестве такой температуры приняли 0 оС. Расчетное выражение средней теплоемкости, определенной от 0 оС, имеет вид
 .
(3.39)
.
(3.39)
Используя эту теплоемкость, можно определить теплоту и среднюю теплоемкость в любом интервале температур процесса (рис.3.3). Площадь под процессом А1 соответствует теплоте q01=cm01t1, а под процессом А2 – теплоте q02=cm02t2, теплота процесса 12 определяется как разность этих площадей:
q12 = q02 - q01 = cm02t2 - cm01t1 . (3.40)
Следовательно, средняя теплоемкость на интервале температур t1 и t2 будет определяться как
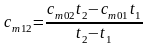
 .
(3.41)
.
(3.41)
В справочных таблицах свойств газов даются значения истинных теплоемкостей при конкретных температурах и средних теплоемкостей в интервале от 0 до t оС. Экспериментально проще определяются изобарные теплоемкости газов. Изохорные теплоемкости газов, подчиняющихся уравнению Pv=RT, рассчитывают по формуле cv=cp-R (Майера). Удельные мольные и объемные теплоемкости реальных газов рассчитываются по их соотношениям с удельными массовыми теплоемкостями.
