
- •Введение техническая термодинамика как теоретическая основа теплоэнергетики
- •1. Общие определения и понятия
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры состояния
- •Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.3.2. Уравнение состояния термодинамической системы
- •1.3.3. Термические коэффициенты
- •1.3.4. Термодинамический процесс
- •2. Первый закон термодинамики для закрытой системы
- •2.1. Работа изменения объема
- •2.2. Теплота, теплоемкость, энтропия
- •2.3. Внутренняя энергия
- •2.4. Первый закон термодинамики для закрытой системы
- •2.4.1. Аналитические выражения первого закона термодинамики.
- •2.4.2. Энтальпия
- •3. Газы и газовые смеси
- •3.1. Законы идеальных газов
- •3.1.1. Внутренняя энергия идеального газа
- •3.1.2. Теплоемкости газов
- •Удельные теплоемкости
- •Теплоемкости процессов
- •Теплоемкости идеальных газов
- •Теплоемкость реальных газов
- •Отношение изобарной и изохорной теплоемкостей
- •3.1.3. Энтальпия идеальных газов
- •3.1.4. Энтропия идеальных газов
- •3.2. Газовые смеси
- •Основные характеристики смеси газов
- •Теплоемкости газовых смесей
- •4. Газовые процессы
- •4.1. Политропные процессы
- •4.2. Частные случаи политропных процессов
- •Уравнения процессов, расчетные выражения их теплоты, работы, изменения внутренней энерги, энтальпии и энтропи
- •4.3. Изображение политропных процессов в р,V и t,s- диаграммах Политропа в р,V- диаграмме
- •Политропа в t,s- диаграмме
- •4.4. Установление показателя политропы по опытным данным
- •4.5. Качественный и количественный анализ политропных процессов в р,V- и t,s- диаграммах
- •4.6. Определение термодинамических свойств идеальных газов с учетом влияния температуры на их изобарную и изохорную теплоемкости
- •Определение энергетических параметров идеальных газов с учетом влияния температуры на cp и cv
3.1.1. Внутренняя энергия идеального газа
Исходя из определения идеального газа в нем отсутствует потенциальная составляющая внутренней энергии (отсутствуют силы взаимодействия молекул, кроме ударного). Таким образом, внутренняя энергия идеального газа представляет собой только кинетическую энергию движения его молекул. Ранее (уравнение (1.10)) было показано, что кинетическая энергия поступательного движения молекул газа прямо пропорциональна его абсолютной температуре:
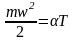 .
.
Используя выражение универсальной газовой постоянной (3.6), можно определить величину константы :
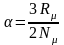 .
.
Таким образом, кинетическая энергия поступательного движения одной молекулы идеального газа будет определяться выражением
 .
(3.10)
.
(3.10)
В соответствии с кинетической теорией распределение энергии по степеням свободы равномерное. У поступательного движения 3 степени свободы. Следовательно, на одну степень свободы движения молекулы газа будет приходитья 1/3 ее кинетической энергии:
 .
(3.11)
.
(3.11)
Для двух, - трех - и многоатомных молекул газа кроме степеней свободы поступательного движения есть степени свободы вращательного движения молекулы (рис.3.1). Для двухатомных молекул газа число степеней свободы вращательного движения равно 2, для трех - и многоатомных молекул – 3.
Поскольку распределение энергии движения молекулы по всем степеням свободы равномерное, а число молекул в одном киломоле газа равняется N, внутреннюю энергию одного киломоля идеального газа можно получить, умножив выражение (3.11) на число молекул в одном киломоле и на число степеней свободы движения молекулы данного газа:
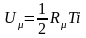 ,
(3.12)
,
(3.12)
где U – внутренняя энергия 1 киломоля газа, Дж/кмоль;
i – число степеней свободы движения 1 молекулы газа.
Для 1-атомного газа i = 3, для 2-атомного газа i = 5, для 3-атомного и многоатомного газов i = 6.
Д ля
многоатомного газа i=6, так как существуют
3 степени свободы поступательного
движения и 3 степени свободы вращательного
движения молекул. Может быть еще
колебательное движение атомов в молекуле,
но его обычно учитывают для реальных
газов, используя экспериментальные
данные. Для идеальных газов колебательное
движение атомов в молекулах тоже может
быть учтено при расчете внутренней
энергии (см. в разд. 4.6). На данном этапе
изложения материала будем руководствоваться
молекулярно-кинетичесой теорией
идеального газа. В соответствии с ней
атомы
в молекулах идеального газа имеют
жесткие связи, т.е. колебательного
движения атомов в молекулах нет.
ля
многоатомного газа i=6, так как существуют
3 степени свободы поступательного
движения и 3 степени свободы вращательного
движения молекул. Может быть еще
колебательное движение атомов в молекуле,
но его обычно учитывают для реальных
газов, используя экспериментальные
данные. Для идеальных газов колебательное
движение атомов в молекулах тоже может
быть учтено при расчете внутренней
энергии (см. в разд. 4.6). На данном этапе
изложения материала будем руководствоваться
молекулярно-кинетичесой теорией
идеального газа. В соответствии с ней
атомы
в молекулах идеального газа имеют
жесткие связи, т.е. колебательного
движения атомов в молекулах нет.
Для одного килограмма идеального газа удельная внутренняя энергия (Дж/кг) определяется делением выражения (3.12) на молярную массу газа:
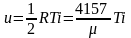 .
(3.13)
.
(3.13)
Для произвольного количества газа внутренняя энергия определяется как произведение его массы на удельную внутреннюю энергию этого газа:
 ,
(3.14)
,
(3.14)
где m – масса газа, кг;
U – полная внутрення энергия идеального газа.
Если система состоит из нескольких различных по физическим свойствам газов, то, подчиняясь закону сложения (аддитивности), его полная внутренняя энергия будет определяться суммой внутренних энергий компонентов газовой смеси:
U = m1u1 + m2u2 + + mnun , (3.15)
где n – число компонентов газа в системе.
Полученные уравнения внутренней энергии идеального газа (3.12) – (3.15) указывают на то, что внутренняя энергия идеального газа зависит только от абсолютной температуры газа и числа степеней свободы движения его молекул:
u = f(T) или (du/dP)T = 0, (du/dv)T = 0. (3.16)
