
- •Введение техническая термодинамика как теоретическая основа теплоэнергетики
- •1. Общие определения и понятия
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры состояния
- •Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.3.2. Уравнение состояния термодинамической системы
- •1.3.3. Термические коэффициенты
- •1.3.4. Термодинамический процесс
- •2. Первый закон термодинамики для закрытой системы
- •2.1. Работа изменения объема
- •2.2. Теплота, теплоемкость, энтропия
- •2.3. Внутренняя энергия
- •2.4. Первый закон термодинамики для закрытой системы
- •2.4.1. Аналитические выражения первого закона термодинамики.
- •2.4.2. Энтальпия
- •3. Газы и газовые смеси
- •3.1. Законы идеальных газов
- •3.1.1. Внутренняя энергия идеального газа
- •3.1.2. Теплоемкости газов
- •Удельные теплоемкости
- •Теплоемкости процессов
- •Теплоемкости идеальных газов
- •Теплоемкость реальных газов
- •Отношение изобарной и изохорной теплоемкостей
- •3.1.3. Энтальпия идеальных газов
- •3.1.4. Энтропия идеальных газов
- •3.2. Газовые смеси
- •Основные характеристики смеси газов
- •Теплоемкости газовых смесей
- •4. Газовые процессы
- •4.1. Политропные процессы
- •4.2. Частные случаи политропных процессов
- •Уравнения процессов, расчетные выражения их теплоты, работы, изменения внутренней энерги, энтальпии и энтропи
- •4.3. Изображение политропных процессов в р,V и t,s- диаграммах Политропа в р,V- диаграмме
- •Политропа в t,s- диаграмме
- •4.4. Установление показателя политропы по опытным данным
- •4.5. Качественный и количественный анализ политропных процессов в р,V- и t,s- диаграммах
- •4.6. Определение термодинамических свойств идеальных газов с учетом влияния температуры на их изобарную и изохорную теплоемкости
- •Определение энергетических параметров идеальных газов с учетом влияния температуры на cp и cv
2.4.2. Энтальпия
Многие термодинамические расчеты облегчаются при использовании аддитивных свойств термодинамических тел, называемых энергетическими или калорическими параметрами состояния. Такое название эти параметры состояния получили потому, что в их единицах измерения присутствует величина энергии (Дж) или (ккал). С некоторыми из них мы уже познакомились: это энтропия S(Дж/К) и внутренняя энергия U(Дж). Теперь познакомимся с энтальпией.
Преобразуем выражение первого закона термодинамики (2.35), записав его в виде
¶q=du+Pdv=du+d(Pv)-vdP=[d(Pv)=vdP+Ppdv]=d(u+Рv)-vdp. (2.38)
В равенстве (2.38) сумма (u + Рv) является функцией состояния или параметром состояния, ее назвали энтальпией и обозначили буквой h:
h = u + Рv . (2.39)
В выражении (2.39) h – удельная энтальпия, для всей массы тела полная энтальпия обозначается буквой H и рассчитывается как
H = mh = U + РV . (2.40)
Полная энтальпия H обладает свойствами аддитивности (суммирования), т.к. внутренняя энергия U и объем V – величины экстенсивные, а давление Р – величина интенсивная. Удельная энтальпия h обладает свойствами интенсивной величины. Энтальпия относится к энергетическим (калорическим) параметрам.
Э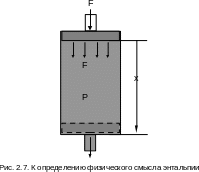 нтальпия
имеет определенный физический смысл
[7]. Прокоментируем физический смысл
энтальпии с помощью рис. 2.7. В цилиндре
с поршнем находится газ при давлении
Р. Силовое воздействие давления газа
на поршень уравновешивается внешним
силовым воздейсвием F, т.е. система
находится в равновесном состоянии.
Энергию газа такой системы можно
представить в виде суммы двух энергий:
внутренней энергии газа – U и потенциальной
энергии газа, которая характеризуется
работой внешних сил, уравновешивающих
давление газа, затраченных на заполнение
газом данного объема.
нтальпия
имеет определенный физический смысл
[7]. Прокоментируем физический смысл
энтальпии с помощью рис. 2.7. В цилиндре
с поршнем находится газ при давлении
Р. Силовое воздействие давления газа
на поршень уравновешивается внешним
силовым воздейсвием F, т.е. система
находится в равновесном состоянии.
Энергию газа такой системы можно
представить в виде суммы двух энергий:
внутренней энергии газа – U и потенциальной
энергии газа, которая характеризуется
работой внешних сил, уравновешивающих
давление газа, затраченных на заполнение
газом данного объема.
Получение потенциальной энергии газом может быть проиллюстрировано в виде работы внешних сил, затраченной на перемещение поршня в цилиндре, в случае заполнения его газом при постоянном давлении от нулевого объема V=0 до объема V. Поскольку при заполнении газом цилиндра над газом со стороны окружающей среды была совершена работа, то энергия газа увеличилась на величину этой работы. Это потенциальная энергия давления газа, которая рассчитывается как произведение внешней силы F на перемещение поршня x или как произведение давления газа на изменение его объема от 0 до V:
Fx = P(V - 0) = PV .
В итоге получили, что полная энергия такой системы есть сумма U+PV, а это и есть энтальпия H=U+PV.
Таким образом, энтальпия есть полная энергия расширенной системы, представляющяя сумму внутренней энергии и внешней – потенциальной энергии давления.
Как любой параметр состояния, энтальпия может быть определена любой парой независимых параметров состояния.
Используя понятие энтальпии, первый закон термодинамики можно записать в виде
¶q = dh - vdР , (2.41)
¶Q = dH - VdР. (2.42)
Из выражения (2.41) видно, что энтальпией удобно пользоваться при определении теплоты в изобарных процессах (Р=const): ¶qp=dhр.
Изобарная теплоемкость тела тоже может быть рассчитана с использованием величины изменения энтальпии:
сp = ¶qp/dT = (¶h/¶T)p . (2.43)
Необходимо обратить внимание на то, что выражение (2.43) справедливо только для изобарных процессов, т.е. разность энтальпий можно рассчитать как произведение изобарной теплоемкости на изменение температуры только при Р=const: dhp=cpdT. В общем случае изменение энтальпии можно представить как полный дифференциал, выраженный через частные производные энтальпии от любой пары независимых параметров состояния. Например, выразим изменение энтальпии через ее зависимость от давления и температуры:
dh = (¶h/¶T)pdT + (¶h/¶P)TdP , (2.44)
используя выражение (2.43) для первого слагаемого, получим
dh = cpdT + (¶h/¶P)TdP . (2.45)
При определении энтальпии, как и для внутренней энергии, выбирают начало отсчета. Хотя выбор параметров начала отсчета энтальпии произволен, т.к. в термодинамике важно не абсолютное ее значение, а разность, необходимо иметь в виду, что начала отсчета и внутренней энергии, и энтальпии связаны между собой. Так, если uо = 0, то при тех же условиях hо = Роvо > uо.
В практике широко используется диаграмма h, s. Для нее начала отсчета энтальпии и энтропии выбираются при одинаковых параметрах состояния. С использованием h, s- диаграммы, легко графически представляются и рассчитываются основные процессы в теплоэнергетике: изобарный, адиабатный, а также оцениваются необратимости на трение и дросселирование.
