
- •Введение техническая термодинамика как теоретическая основа теплоэнергетики
- •1. Общие определения и понятия
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры состояния
- •Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.3.2. Уравнение состояния термодинамической системы
- •1.3.3. Термические коэффициенты
- •1.3.4. Термодинамический процесс
- •2. Первый закон термодинамики для закрытой системы
- •2.1. Работа изменения объема
- •2.2. Теплота, теплоемкость, энтропия
- •2.3. Внутренняя энергия
- •2.4. Первый закон термодинамики для закрытой системы
- •2.4.1. Аналитические выражения первого закона термодинамики.
- •2.4.2. Энтальпия
- •3. Газы и газовые смеси
- •3.1. Законы идеальных газов
- •3.1.1. Внутренняя энергия идеального газа
- •3.1.2. Теплоемкости газов
- •Удельные теплоемкости
- •Теплоемкости процессов
- •Теплоемкости идеальных газов
- •Теплоемкость реальных газов
- •Отношение изобарной и изохорной теплоемкостей
- •3.1.3. Энтальпия идеальных газов
- •3.1.4. Энтропия идеальных газов
- •3.2. Газовые смеси
- •Основные характеристики смеси газов
- •Теплоемкости газовых смесей
- •4. Газовые процессы
- •4.1. Политропные процессы
- •4.2. Частные случаи политропных процессов
- •Уравнения процессов, расчетные выражения их теплоты, работы, изменения внутренней энерги, энтальпии и энтропи
- •4.3. Изображение политропных процессов в р,V и t,s- диаграммах Политропа в р,V- диаграмме
- •Политропа в t,s- диаграмме
- •4.4. Установление показателя политропы по опытным данным
- •4.5. Качественный и количественный анализ политропных процессов в р,V- и t,s- диаграммах
- •4.6. Определение термодинамических свойств идеальных газов с учетом влияния температуры на их изобарную и изохорную теплоемкости
- •Определение энергетических параметров идеальных газов с учетом влияния температуры на cp и cv
2.4. Первый закон термодинамики для закрытой системы
В технической термодинамике в основном рассматривают процессы изменения состояния термодинамического тела, находящегося только в тепловом и механическом взаимодействии с телами внешней среды.
Ранее мы условились, что все процессы будем рассматривать применительно к закрытым термодинамическим системам (без обмена веществом с окружающей средой). Если термодинамическое тело (система) находится в покое или скорость его движения не меняется, т.е. не меняется его кинетическая энергия видимого движения, а также не меняется положение его центра тяжести по отношению к центру Земли, т.е. не меняется его потенциальная энергия в гравитационном поле Земли, то нет изменения запаса его механической энергии. Результатом его взаимодействия с внешней средой в этом случае является изменение его внутренней энергии. Внутренняя энергия может быть изменена за счет подвода (отвода) к телу теплоты (совершения тепловой работы) и за счет совершения над ним со стороны окружающей среды (или самим телом над окружающей средой) работы изменения объема (механической работы). И то и другое является мерой энергетического взаимодействая тела и внешней среды, мерой передачи телу энергии от внешних источников. Согласно закону сохранения энергии в этой системе изменение ее внутренней энергии будет равно сумме внешних тепловых и механических работ.
Таким образом, аналитическое выражение первого закона термодинамики для замкнутой системы будет иметь следующий вид:
U2 - U1 = Q - L', (2.27)
где U2 - U1 – изменение внутренней энергии системы;
Q – количество теплоты, полученное телом (системой) от внешней среды;
L' – работа расширения, совершаемая телом (системой) над внешней средой. Штрих указывает на то, что это работа расширения действительного необратимого процесса. Подробное изложение различия работ расширения в обратимых и в необратимых процессах будет приведено в следующем разделе.
В выражении (2.27) знак минус перед работой изменения объема обусловлен правилом знаков, согласно которому принято, что увеличение внутренней энергии тела (U2-U1>0) возможно за счет подводa к нему теплоты (Q имеет знак «плюс» согласно расчетному выражению dQ=TdS при подводе к телу теплоты (dS>0 и Q>0)) и за счет совершения над ним работы изменения объема со стороны внешней среды (L' – работа изменения объема самого тела, -L' – работа изменения объема внешней среды над телом согласно расчетному выражению для работы изменения объема обратимого процесса dL=PdV при совершении механической работы над телом со стороны окружающей среды (dV<0 и L<0), т.е. в этом случае -L>0).
Очевидно, что изменение внутренней энергии может быть вызвано энергетическим взаимодействием тела с окружающей средой одного вида: или только механического, или только теплового. Из выражения (2.27) следует принцип эквивалентности работы расширения (механической работы) и теплоты (тепловой работы), т.е. одинаковость их природы, а соответственно и их единиц измерения. Вот некоторые из часто встречающихся соотношений:
1 ккал = 4,187 кДж; 1 кВт∙ч = 3600 кДж = 860 ккал.
Длительное время природу теплоты объясняли с помощью ложной теории теплорода. Единица измерения теплоты была только в калориях, эквивалента теплоты и механической работы не было. Одинаковую природу теплоты и механической работы доказал английский физик Д.Джоуль в 1843–1850 гг. [7]. Он же определил эквивалент механической и тепловой работы (1 ккал = 427 кгм).
Д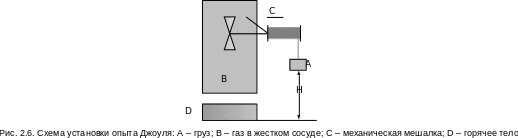 жоуль
провел следующий опыт (рис. 2.6). В замкнутый
жесткий сосуд В с газом, исключающий
механическое взаимодействие газа и
внешней среды путем изменения объема
газа, поместили мешалку. Механическое
взаимодействие газа с внешней средой
(без изменения объема газа) может
осуществляться вращением мешалки,
приводимой в действие за счет опускания
груза А. Тепловое взаимодействие газа
с внешней средой может осуществляться
с помощью его контакта с телом D, имеющим
температуру большую, чем у газа (tD>tB).
жоуль
провел следующий опыт (рис. 2.6). В замкнутый
жесткий сосуд В с газом, исключающий
механическое взаимодействие газа и
внешней среды путем изменения объема
газа, поместили мешалку. Механическое
взаимодействие газа с внешней средой
(без изменения объема газа) может
осуществляться вращением мешалки,
приводимой в действие за счет опускания
груза А. Тепловое взаимодействие газа
с внешней средой может осуществляться
с помощью его контакта с телом D, имеющим
температуру большую, чем у газа (tD>tB).
Изменение состояния газа в сосуде (например, ориентируясь на температуру и давление) можно осуществить двумя способами: механическим – путем вращения мешалки, и тепловым – нагревая газ с помощью тела D. В обоих случаях будет происходить изменение внутренней энергии газа. Джоуль добился одинакового изменения состояния газа механическим и тепловым взаимодествиями газа с внешней средой, т.е. в начале и в конце каждого энергетического взаимодействия параметры газа были одинаковы, например P1 и t1, P2 и t2. Поскольку одинаковы начальные и конечные состояния газа в обоих опытах, то одинаково и изменение внутренней энергии газа в этих опытах. Исходя из этого, можно записать:
U2 - U1 = -L' = mgH, U2 - U1 = Q, -L' = Q. (2.28)
В соответствии с выражением (2.28) получили эквивалентность механической работы, произведенной над газом, и теплоты, подведенной к газу.
Единицы измерения теплоты и механической работы расширения в СИ одинаковы – джоуль (Дж), поэтому в данной системе единиц выражение первого закона термодинамики не требует ввода эквивалента между единицами теплоты и работы, как это была в XXIX веке.
