
- •Оглавление.
- •Введение.
- •Аминокислоты.
- •Структура белков
- •Конформация белков
- •Тема: пептиды, белки: их строение, свойства, значение в организме, методы исследования. Физико-химические свойства белков. Пептиды
- •Роль белков в организме человека
- •Методы разделения белков и пептидов:
- •Признаки коллоидного состояния:
- •Сходство растворов вмс и коллоидных растворов:
- •Отличие растворов вмс от коллоидных растворов:
- •Сходство растворов вмс с ионно-молекулярными растворами:
- •Специфические свойства растворов вмс:
- •Анализ мембранного равновесия Доннана
- •Ферменты
- •Отличие ферментов от неорганических катализаторов
- •Строение ферментов
- •Активный центр ферментов.
- •Механизм действия ферментов
- •Специфичность
- •Кинетика ферментативных реакций
- •2. Концентрация субстрата
- •РН среды
- •Активирование ферментов
- •6. Ингибирование.
- •Определение активности фермента
- •Классификация ферментов
- •Трансферазы
- •Гидролазы
- •Изомеразы
- •Лигазы (синтетазы)
- •Тема: ферменты, как биологические катализаторы
- •Классификация ферментов
- •Свойства ферментов
- •Специфичность действия ферментов
- •Активирование и ингибирование ферментов
- •Регуляция путём ковалентной модификации
- •Путь нековалентной модификации
- •Типы ингибирования
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Регуляция путем изменения биосинтеза ферментов
- •Компартментализация (отделение, отсек) в клетке
- •Изоферменты
- •Анализ уравнения Михаэлиса—Ментен:
- •Количественная характеристика активности фермента
- •Количественная характеристика активности ферментов в биологических жидкостях
- •Энзимодиагностика
- •Наследственные нарушения (энзимопатии)
- •Энзимотерапия
- •Липиды. Классификация липидов. Характеристика фосфолипидов и восков.
- •Обмен липидов
- •Ресинтез жирных кислот в стенке кишечника.
- •Транспорт липидов
- •Цикл трикарбоновых кислот (цикл Кребса)
- •Тема углеводы
- •Классификация углеводов
- •Моносахариды.
- •Стериоизомерия моносахаридов.
- •Циклические (полуацетальные) формы моносахаридов.
- •Основные реакции моносахаридов.
- •1. Реакции полуацетального гидроксила.
- •3. Реакции с участием карбонильной группы.
- •Олигосахариды
- •Полисахариды
- •Гетерополисахариды.
- •Промежуточный обмен углеводов в организме
- •Витамины
- •Классификация витаминов
- •Жирорастворимые витамины Витамины группы а (ретинол, антиксерофтальмический)
- •Биологическая роль
- •Витамины группы к (филлохиноны, менахиноны,антигеморрагический)
- •Витамины группы е (токоферол, антистерильный. Витамин размножения)
- •Водорастворимые витамины Витамин в1 (тиамин, антиневрический)
- •Биологическая роль
- •Витамин в2 (рибофлавин, витамин роста)
- •Витамин в6 (пиридоксин, антидермический)
- •Витамин в12 (кобаламин,антианемический)
- •Витамин с (аскорбиновая кислота, антискорбутный витамин).
- •Витамин р (рутин, цитрин, витамин проницаемости)
- •Витамин рр (никотиновая кислота, никотинамид, ниацин, антипеллагрический)
- •Авитаминоз и гиповитаминоз
- •Химия нуклеиновых кислот. Общая характеристика нуклеиновых кислот
- •Химическое строение рнк и днк.
- •Азотистое основание Углеводный компонент Фосфорная кислота
- •П уриновые Пиримидиновые Рибоза Дезоксирибоза
- •Углеводный компонент
- •Азотистое основание
- •Структура нуклеиновых кислот.
- •Вторичная структура днк характеризуется правилом э. Чаргаффа (закономерность количественного содержания азотистых оснований):
- •Тема: обмен нуклеиновых кислот и нуклеотидов в организме человека.
- •Этапы репликации:
- •Транскрипция
- •Этапы транскрипции:
- •Биосинтез белка
- •Регуляция транскрипции. Теория Оперона
- •Тема: энергетический обмен. Цикл лимонной кислоты - цикл трикарбоновых кислот (цтк), цикл Кребса - конечный общий путь окисления белков, липидов, углеводов.Цтк - амфиболический цикл.
- •Цикл лимонной кислоты — цтк — цикл Кребса
- •Энергетическая роль цтк
- •Регуляция цикла Кребса
- •Биоэнергетика. Биологическое окисление Роль кислорода в метаболизме
- •Токсичность кислорода
- •Макроэргические молекулы
- •Нуклеозидтрифосфаты
Биологическая роль
ТПФ участвует в реакциях декарбоксилирования α-кетокислот;
ТПФ участвует в расщеплении и синтезе α-оксикислот (например, кетосахаров), т.е. в реакциях синтеза и расщепления углерод-углеродных связей, находящихся в непосредственной близости к карбонильной группе.
Тиамин-зависимые ферменты – пируватдекарбоксилаза и транскетолаза.
Авитаминоз и гиповитаминоз.
Болезнь бери-бери, нарушения функций пищеварительного тракта, изменения психики, изменения деятельности сердечно-сосудистой деятельности, развитие отрицательного азотистого баланса и т.д.
Источники: растительные продукты, мясо, рыба, молоко, бобовые растения – фасоль, горох, соя и др.
Суточная потребность: 1,2-2,2 мг.
Витамин в2 (рибофлавин, витамин роста)
Кроме самого рибофлавина в природных источниках содержатся его коферментные производные: флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Эти коферментные формы витамина В2 количественно преобладают в большинстве животных и растительных тканей, а также в клетках микроорганизмов.
В зависимости от источника получения витамин В2 называли по разному: лактофлавин (из молока), гепафлавин (из печени), вердофлавин (из растений), овофлавин (из яичного белка).
Химическая структура: в основе молекулы рибофлавина лежит гетероциклическое соединение – изоаллоксазин (сочетание бензольного, пиразинового и пиримидинового колец), к которому в положении 9 присоединен пятиатомный спирт рибитол. Химический синтез рибофлавина осуществлен в 1935 г. Р.Куном.
1
9
2
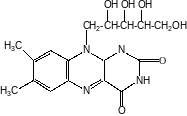
Рибофлавин
Растворы витамина В2 имеют оранжево-желтую окраску и характеризуются желто-зеленой флюоресценцией.
Желтый цвет присущ окисленной форме препарата. Рибофлавин в восстановленной форме – бесцветен.
В2 хорошо растворим в воде, устойчив в кислых растворах,легко разрушается в нейтральных и щелочных растворах. В2 чувствителен к видимому и УФ-излучению, легко подвергается обратимому восстановлению, присоединяя Н2 по месту двойной связи и превращаясь в бесцветную лейкоформу. Это свойство витамина В2 легко окисляться и восстанавливаться лежит в основе его биологического действия в клеточном метаболизме.
Авитаминоз и гиповитаминоз: остановка роста, выпадение волос, воспалительные процессы слизистой оболочки языка, губ и т.д. Кроме того, общая мышечная слабость и слабость сердечной мышцы; помутнение хрусталика (катаракта).
Биологическая роль:
Входит в состав флавиновых коферментов ФАД, ФМН, которые являются простетическими группами флавопротеинов;
Участвует в составе ферментов при прямом окислении исходного субстрата с участием О2, т.е. дегидрировании. К коферментам этой группы относятся оксидазы L- и D-аминокислот;
В составе флавопротеинов осуществляют перенос электронов от восстановленных пиридиновых коферментов.
Источники: дрожжи, хлеб (мука грубого помола), семена злаковых, яйца, молоко, мясо, свежие овощи, молоко (в свободном состоянии), печень и почки (в составе ФАД и ФМН).
Суточная потребность: 1,7мг.
Витамин в6 (пиридоксин, антидермический)
Открыт в 1934 г. П. Дьерди. Впервые выделен из дрожжей и печени.
Химическая структура. Витамин В6 является производным 3-оксипиридина. Термином «витамин В6» по рекомендации Международной комиссии по номенклатуре биологической химии, обозначают все три производных 3-оксипиридина, обладающих одинаковой витаминной активностью: пиридоксин (пиридоксол), пиридоксаль и пиридоксамин.



пиридоксин пиридоксаль пиридоксамин
В6 хорошо растворим в воде и этаноле. Водные растворы весьма устойчивы по отношению к кислотам и щелочам, но чувствительны к свету в нейтральной зоне рН.
Авитаминозы гиповитаминоз. У человека недостаточность витамина В6 проявляется в угнетении выработки эритроцитов, дерматите, воспалительных процессах кожи, замедлении роста животных, нарушении обмена триптофана.
Биологическая роль. Все три производные 3-оксипиридина наделены витаминными свойствами, коферментные функции выполняют только фосфорилированные производные пиридоксаля и пиридоксамина:


пиридоксаминфосфат пиридоксальфосфат
Пиридоксаминфосфат как кофермент функционирует в реакциях превращения карбонильных соединений, например в реакциях образования 3,6-дтдезоксигексоз,входящих в антигены, локализованные на поверхности бактериальных клеток.
Биохимические функции пиридоксальфосфата:
транспортная – участие в процессе активного переноса некоторых аминокислот через клеточные мембраны;
каталитическая – участие в качестве кофермента в широком круге ферментативных реакций (переаминирование, декарбоксилирование, рацемизация аминокислот и др.);
функция регулятора скорости оборота пиридоксалевых ферментов – удлинение времени полураспада в тканях некоторых пиридоксальных апоферментов при их насыщении пиридоксальфосфатом,повышающим устойчивость апоферментов к тепловой денатурации и действию специфических протеиназ.
При недостаточности витамина В6 наблюдаются нарушения метаболизма аминокислот.
Источники: в продуктах растительного и животного происхождения (хлеб, горох, фасоль, картофель, мясо, печень и т.д.). Он также синтезируется микрофлорой кишечника!
Суточная потребность: около 2 мг.
