
- •Введение
- •Тема 1. Поли- и гетерофункциональные органические соединения – метаболиты и биорегуляторы. Многоатомные спирты, фенолы. Производные п-аминофенола.
- •Опыт №1. Обнаружение воды в спирте
- •Опыт №2. Окисление этилового спирта хромовой смесью
- •Опыт №3. Образование йодоформа из спирта
- •Опыт №4. Комплексообразование многоатомных спиртов
- •Опыт №5. Реакция фенолов с хлоридом железа (III)
- •Опыт №6. Бромирование фенола
- •Тема 2. Поли- и гетерофункциональные органические соединения – метаболиты и биорегуляторы. Аминоспирты. Полиамины. Производные п-аминобензойной и сульфаниловой кислот.
- •Опыт №1. Комплексообразующие свойства коламина
- •Опыт №2. Взаимодействие новокаина с основанием
- •Тема 3. Поли- и гетерофункциональные органические соединения – метаболиты и биорегуляторы. Многоосновные карбоновые кислоты, гидрокси-, оксокислоты. Салициловая кислота и ее производные.
- •Опыт №1. Качественная реакция на ацетат-ион
- •Опыт №2. Качественная реакция на цитрат-ион
- •Опыт №3. Открытие щавелевой кислоты в виде кальциевой соли
- •Опыт №4. Получение этилацетата
- •Тема 4. Биологически активные гетероциклические соединения – структурные компоненты витаминов, биорегуляторов и лекарственных средств.
- •Опыт №1. Получение солей мочевой кислоты
- •Опыт №2. Качественная реакция на никотиновую кислоту
- •Опыт №3. Качественная реакция на витамин в6
- •Тема 5. Биологически активные гетероциклические соединения – структурные компоненты алкалоидов и антибиотиков.
- •Тема 6. Контрольная работа №1.
- •I. Тестовые задания:
- •II. Билет:
- •III. Карточки:
- •Тема 7. Моносахариды. Олигосахариды.
- •Тема 8. Полисахариды.
- •Опыт №1. Доказательство наличия диольного фрагмента в глюкозе
- •Опыт №2. Восстановление гидроксида меди (II) глюкозой
- •Опыт №3. Восстановительные свойства глюкозы (реакция с реактивом Фелинга)
- •Опыт №4. Восстановление гидроксида диаммминсеребра глюкозой
- •Опыт №5. Реакция Селиванова на фруктозу
- •Опыт №6. Отсутствие восстановительной способности у сахарозы
- •Опыт №7. Качественная реакция на крахмал
- •Опыт №8. Гидролиз крахмала в кислой среде
- •Тема 9. Аминокислоты. Производные аминокислот.
- •Опыт №1. Амфотерные свойства α-аминокислот
- •Опыт №2. Образование внутрикомплексных солей α-аминокислот
- •Опыт №3. Образование оснований Шиффа
- •Опыт №4. Дезаминирование α-аминокислот
- •Опыт №5. Общая реакция обнаружения α-аминокислот (нингидриновая реакция)
- •Опыт №6. Обнаружение ароматических α-аминокислот (ксантопротеиновая реакция)
- •Опыт №7. Обнаружение меркаптогруппы в цистеине
- •Тема 10. Пептиды. Белки. Понятие о пептидных гормонах.
- •Опыт №1. Обнаружение пептидной группы (биуретовая реакция)
- •Тема 11. Контрольная работа №2.
- •I. Тестовые задания:
- •II. Билет:
- •III. Карточки:
- •Тема 12. Нуклеотиды, метаболиты и биорегуляторы.
- •Тема 13. Липиды. Структура липидов клеточных мембран.
- •Опыт №1. Качественные реакции на кратную углерод-углеродную связь
- •Тема 14. Пероксидное окисление липидов.
- •Тема 15. Низкомолекулярные биорегуляторы. Стероиды.
- •Опыт №1. Свойства холестерина
- •Тема 16. Низкомолекулярные биорегуляторы. Терпены, эйкозаноиды.
- •Опыт №1. Доказательство кратных связей в ретиноле
- •Опыт №2. Обнаружение токоферола (витамина е)
- •Тема 17. Контрольная работа №3. Зачетное занятие.
- •I. Тестовые задания:
- •II. Билет:
- •III. Карточки:
- •I. Тестовые задания:
- •Список основной и дополнительной литературы, информационное обеспечение обучения
- •3. Программное обеспечение и интернет-ресурсы
Опыт №1. Обнаружение воды в спирте
В присутствии воды безводный сульфат меди (II) образует кристаллогидрат CuSO4·5H2O голубого цвета. CuSO4·+ 5H2O → CuSO4·5H2O
Реактивы: 95% этанол, сульфат меди (II).
Оборудование: пробирки, спиртовка, пробиркодержатель, штативы, пипетки, дозаторы, лопаточка, вытяжной шкаф.
Методика эксперимента: В сухую пробирку наливают 2 мл этилового спирта и добавляют к нему 1,5 - 2,0 г безводного сульфата меди (II). Пробирку встряхивают и нагревают на слабом огне.
Опыт №2. Окисление этилового спирта хромовой смесью
Течение реакции обнаруживается по изменению окраски раствора на зеленоватую, характерную для солей хрома (III), а образование ацетальдегида – по характерному запаху антоновских яблок. Ацетальдегид в избытке дихромата калия в дальнейшем окисляется до уксусной кислоты. Эта реакция используется для экспресс-анализа следовых количеств этилового спирта в выдыхаемом воздухе.
3CH3-CH2-OH + К2Сr2O7 + 4H2SO4 → 3CH3-CH=O + Сr2(SO4)3 + К2SO4 + 4H2O
Реактивы: 95% этанол, 0,1 моль/л раствор дихромата калия, 2 моль/л раствор серной кислоты.
Оборудование: пробирки, спиртовка, пробиркодержатель, штативы, пипетки, дозаторы, стеклянная палочка, вытяжной шкаф.
Методика эксперимента: В пробирку помещают 2 капли этанола, 2 капли 0,1 моль/л раствора дихромата калия и 1 каплю 2 моль/л серной кислоты. Полученный оранжевый раствор слегка нагревают над пламенем спиртовки до начала изменения цвета.
Опыт №3. Образование йодоформа из спирта
Ничтожно малая растворимость йодоформа в воде позволяет обнаружить по реакции его образования даже следы этилового спирта в водном растворе, что широко используется в химико-токсилогическом анализе.
В условиях опыта йод и щелочь вступают в реакцию: I2 + 2NaOH ↔ NaOI + NaI + H2O.
Образующаяся соль йодноватистой кислоты является сильным окислителем и переводит первичные спирты в альдегиды, а вторичные спирты в кетоны.
CH3-CH2-OH + NaOI → CH3-CH=O + NaI + H2O
Атомы водорода в группах –СО-СН3, -СО-СН2-, -СО-СН- легко замещаются йодом.
CH3-CH=O + 3NaOI → CI3-CH=O + 3NaOH
CI3-CH=O + NaOH → CHI3 + HCOONa
Реактивы: 95% этанол, дистиллированная вода, 5% раствор йода, 1% раствор гидроксида натрия.
Оборудование: пробирки, водяная баня, пробиркодержатель, штативы, пипетки, дозаторы, стеклянная палочка, вытяжной шкаф.
Методика эксперимента: В пробирку помещают 3-4 капли исследуемого спирта, 2-3 мл воды и перемешивают. Полученный раствор слегка нагревают на водяной бане при 600С, добавляют к нему 0,5-1,0 мл раствора йода и затем приливают разбавленный раствор щелочи по каплям до исчезновения окраски. В случае образования йодоформа выделяется светло-желтая муть или осадок и появляется характерный запах.
Опыт №4. Комплексообразование многоатомных спиртов
Качественная реакция на α-диольный фрагмент проводится свежеприготовленным гидроксидом меди (II); либо реактивом Фелинга, содержащим катионы меди (II), стабилизированные раствором калиево-натриевой соли винной кислоты (тартрат-ионами); либо реактивом Бенедикта, содержащим катионы меди (II), стабилизированные раствором соли лимонной кислоты (цитрат-ионами). CuSO4 + 2NaOH → Na2SO4 + Cu(ОН)2
2
НО–СН2–СН2–ОН
+ Cu(OH)2
→ 2H2O
+
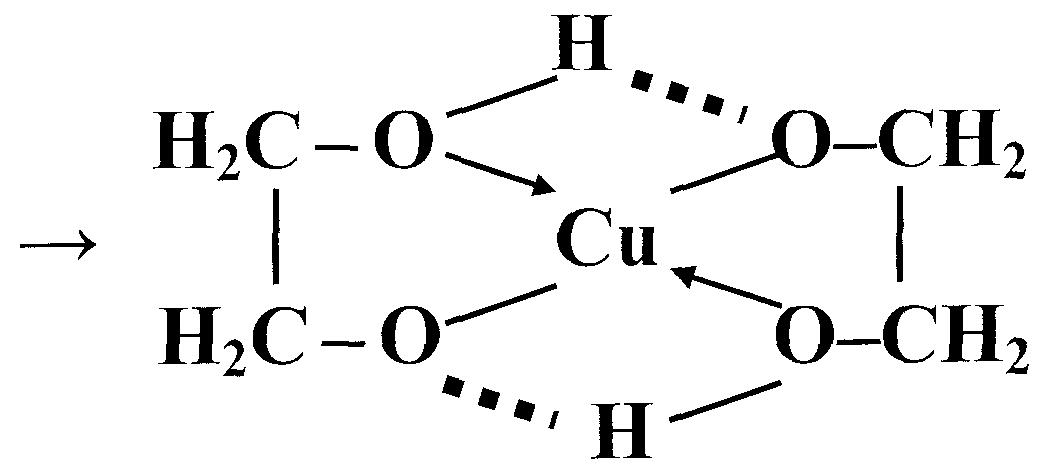
Реактивы: 2% раствор сульфата меди, 10% раствор гидроксида натрия, глицерин.
Оборудование: пробирки, штативы, пипетки, дозаторы, стеклянная палочка, вытяжной шкаф.
Методика эксперимента: В пробирку помещают 5 капель 2% раствора сульфата меди (II) и 5 капель 10% раствора гидроксида натрия, затем к свежеприготовленному гидроксиду меди (II) добавляют 3-5 капель глицерина. Пробирку встряхивают, дают содержимому отстояться и отмечают появление характерной окраски жидкости.
