
- •Содержание
- •Предисловие
- •Единицы измерения
- •Единицы системы си
- •Единицы, допускаемые к применению наравне с единицами си
- •Десятичные приставки к названиям единиц
- •Основные физические постоянные
- •Значения универсальной газовой постоянной r в различных единицах
- •Коэффициенты перехода от массы к энергии
- •Термодинамические характеристики неорганических и органических веществ
- •Термодинамические константы некоторых
- •Термодинамические характеристики некоторых органических веществ
- •Теплота сгорания органических веществ
- •Интегральная теплота растворения солей δн солей в воде при 250с
- •Интегральная теплота растворения солей δн солей в воде при 250с
- •Интегральная теплота растворения (-δн)кислот и оснований
- •Интегральная теплота растворения солей,
- •Свойства растворов Криоскопические и эбулиоскопические константы растворителей
- •Криоскопические константы
- •Константы диссоциации кислот и оснований в водных растворах.
- •Константы диссоциации некоторых органических и неорганических оснований
- •Константы диссоциации некоторых неорганических кислот
- •Константы диссоциации некоторых органических кислот
- •Константа диссоциации воды
- •Давление насыщенного водяного пара в равновесии с водой.
- •Плотность воды при различной температуре
- •Плотности и концентрации некоторых неорганических веществ Растворов азотной кислоты
- •Растворов серной кислоты
- •Растворов соляной кислоты
- •Растворов уксусной кислоты
- •Растворов гидроксида калия
- •Гидроксида натрия
- •Раствор аммиака
- •Растворов карбоната натрия
- •Растворов некоторых солей
- •Формулы пересчета концентрации растворов
- •Весовые концентрации
- •Формулы и зависимости, используемые при приготовлении растворов
- •Растворение вещества в растворителе:
- •Правило смешения(«правило креста»):
- •Переход от концентраций к активностям
- •Буферные растворы
- •Комплексные соединения
- •Координационные числа (к.Ч.) в кристаллах
- •Равновесие системы раствор - твердое вещество
- •Произведения растворимости малорастворимых в воде электролитов
- •Растворимость различных веществ в воде
- •РН осаждения гидроокисей металлов
- •Электрохимия Стандартные электродные потенциалы в водных растворах
- •Стандартные электродные потенциалы в водных растворах (Ряд напряжений металлов)
- •Перенапряжение водорода и кислорода (в)
- •Строение вещества Атомные и ионные радиусы
- •Сродство атомов к электрону
- •Энергия ионизации атомов, молекул, радикалов
- •Энергия и длина связи
- •Полярность молекул.
- •Дипольные моменты некоторых молекул в газообразном состоянии
- •Дипольный момент молекул, диэлектрическая проницаемость и поляризация жидкостей
- •Строение и константы многоатомных молекул в газообразном состоянии
- •Энергия кристаллических решеток
- •Индикаторы Кислотно-основные индикаторы
- •Редокс-индикаторы
- •Индикаторы в комплексонометрии
- •Техника безопасности
- •Предельно допустимые концентрации (пдк) вредных веществ в производственных помещениях
- •Предельно допустимые концентрации вредных веществ в воде водоемов
- •Ядовитые вещества и меры первой помощи при отравлении
- •Кислоты
- •Плавиковая (фтористоводородная),
- •Синильная (цианистоводородная) кислота
- •Основания
- •Калия гидрат окиси (едкое кали)
- •Кальция окись (негашеная известь)
- •Натрия гидрат окиси (едкий натр)
- •Марганцевокислые
- •Металлы
- •Металлоиды
- •Органические вещества
- •Опасные и взрывоопасные вещества хранение и способы тушения пожара
- •Общая характеристика огнеопасности и взрывоопасности веществ
- •Огнеопасные и взрывоопасные свойства газов в смеси с воздухом
- •Огнеопасные и взрывоопасные свойства пылевоздушных смесей некоторых материалов и металлов
- •Огнеопасные и взрывоопасные жидкости
- •1,4 Диоксан:
- •Скорость выгорания некоторых горючих жидкостей со свободной поверхности
- •Вещества, дающие химические ожоги кожи, и меры первой помощи
- •Оказание первой помощи при термических ожогах
- •Оказание первой помощи при ранениях
- •Растворимость солей и оснований в воде при 250 с
- •Электроотрицательность элементов по шкале Полинга
- •Список использованной литературы
Формулы и зависимости, используемые при приготовлении растворов
Растворение вещества в растворителе:
х = Св·а/100; b= а - х,
где х - масса растворяемого вещества, необходимая для приготовления заданного количества (а) раствора с требуемой весовой концентрацией в % (Св); b - масса растворителя.
При растворении кристаллогидрата в воде необходимо учитывать, что содержащаяся в нем кристаллизационная вода разбавляет раствор. Тогда используется формула:
х= Св.в.·z/1-(Св.в.(z-1)/100),
где Св.в. - заданная концентрация безводного вещества в растворе в г на 100 г воды; х -масса кристаллогидрата, которую следует растворить в 100 г воды, чтобы приготовить раствор с концентрацией Св.в., z-отношение М1/М (М1 и М - молекулярные массы кристаллогидрата и безводного вещества соответственно)
Разбавление раствора растворителем:
х=b(1-n/m); х = а(m/n-1); b=а + х,
где х -масса растворителя, необходимая для разбавления а единиц массы раствора с данной концентрацией (m вес. %) до требуемой (n вес. %); b-масса раствора после разбавления.
Концентрирование раствора выпариванием:
х = а(n-m)/n; а = х +b,
где х -масса растворителя, которую необходимо выпарить из а единиц массы раствора с данной концентрацией (m вес. %), чтобы получить раствор с требуемой концентрацией (n вес. %), n>m; b-масса раствора после выпаривания растворителя.
4. Смешение двух растворов с различной концентрацией:
а=с(l-n)/(m-n)=b(l-n)/(m-l); b=а(m-l)/(l-n)=c(m-l)/m-n; с =a+b,
где а - масса раствора с концентрацией m; b - масса раствора с концентрацией n; m и n - концентрации в растворах(в вес. %) до смешения, m>n; с - масса смеси с концентрацией l; l - требуемая концентрация растворенного вещества в смеси (вес. %).
Смешение двух растворов различных веществ:
а = m′·c/m; b=n′·c/n; а +b=с
m=m′·c/a; n=n′·c/b; n′=b·n/c; m′ +n′ +l=100,
где а и b - соответственно массы раствора вещества А и раствора вещества В, необходимые для приготовления смеси; m и n - концентрации раствора вещества А (вес. % А) и раствора вещества В (вес. % В); m′ и n′ - процентное содержание вещества А и вещества В в смеси; l - процентное содержание растворителя в смеси.
Правило смешения(«правило креста»):
Применяется для упрощения расчетов в случае приготовления раствора заданной концентрации (в вес. %) путем разбавления растворителем или смешения двух растворов.
Заданная концентрация раствора пишется в месте пересечения двух линий, а концентрации исходных растворов (для растворителя она равна нулю) - у концов обеих линий слева. Затем для каждой линии производится вычитание одного стоящего на ней числа из другого и разность записывается у свободного конца той же линии. Направление вычислений указывается стрелками. Полученные числа располагают у концов соответствующей линии справа. Они указывают, сколько единиц массы каждого раствора следует взять, чтобы получить раствор с заданной концентрацией:
а
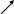 )
50 15 б) 50 25
)
50 15 б) 50 25
 25
25
25
25
10 25 0 25
А) Для получения 25%-ного раствора из 50 %-ного и 10 %-ного следует взять 15 единиц массы 50 %-ного раствора и 25 единиц массы 10%-ного.
Б) Для разбавления 50%-ного раствора до 25%-ного следует взять 25 единиц массы 50%-ног раствора и 25 единиц массы растворителя.
