
- •Физика лабораторный практикум
- •Часть 1
- •Введение
- •Расчет погрешностей при определении объема тела правильной формы
- •1.1.Теоретическое обоснование работы
- •1.2. Порядок выполнения работы
- •1.3. Содержание отчета
- •1.4. Контрольные вопросы
- •Определение коэффициентов сухого трения
- •2.1. Теоретическое обоснование работы
- •2.2. Описание лабораторной установки
- •2.3. Порядок выполнения работы
- •2.4. Содержание отчета
- •2.5. Контрольные вопросы
- •Определение логарифмического декремента затухания, коэффициента затухания и коэффициента сопротивления
- •3.1. Теоретическое обоснование работы
- •3.2. Описание лабораторной установки
- •3.3. Порядок выполнения работы
- •3.4. Содержание отчета
- •3.5. Контрольные вопросы
- •Определение момента инерции твердого тела
- •4.1. Теоретическое обоснование работы
- •4.2. Описание лабораторной установки
- •4.3. Порядок выполнения работы
- •4.4. Содержание отчета
- •4.5. Контрольные вопросы
- •Изучение закона сохранения энергии
- •5.1. Теоретическое обоснование работы
- •5.2. Описание лабораторной установки
- •5.3. Порядок выполнения работы
- •5.4. Содержание отчета
- •5.5. Контрольные вопросы
- •Определение коэффициента вязкости воздуха, средней длины свободного пробега и эффективного диаметра молекул
- •6.1. Теоретическое обоснование работы
- •6.2 Описание лабораторной установки
- •6.3. Порядок выполнения работы
- •6.3. Содержание отчета
- •6.4. Контрольные вопросы
- •Экспериментальное изучение газового закона бойля-мариотта
- •7.1. Теоретическое обоснование работы
- •7.2. Описание лабораторной установки
- •7.3. Порядок выполнения работы
- •7.4. Содержание отчета
- •7.5. Контрольные вопросы
- •Определение отношения теплоемкостей воздуха методом адиабатического расширения
- •8.1. Теоретическое обоснование работы
- •8.2. Описание лабораторной установки
- •8.3. Порядок выполнения работы
- •8.4. Содержание отчета
- •9.2. Описание лабораторной установки
- •9.3. Порядок выполнения работы
- •9.4. Содержание отчета
- •9.5. Контрольные вопросы
- •Определение коэффициента поверхностного натяжения воды на границе с воздухом методом отрыва кольца
- •10.1. Теоретическое обоснование работы
- •10.2. Описание лабораторной установки
- •10.3. Порядок выполнения работы
- •10.4. Содержание отчета
- •10.5. Контрольные вопросы
10.1. Теоретическое обоснование работы
Между молекулами вещества действуют силы молекулярного притяжения и отталкивания. На рис. 10.1 изображена зависимость сил отталкивания и притяжения двух соседних молекул от расстояния между их центрами. Равнодействующая сил притяжения и отталкивания, действующих на каждую молекулу, изображена пунктирной линией. Эта равнодействующая дважды обращается в ноль – при расстояниях 2rм и r0.
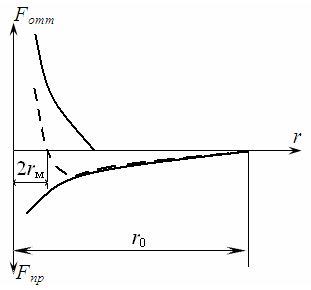
Рисунок 10.1 – Зависимость сил отталкивания Fотт и притяжения Fпр двух соседних молекул от расстояния между их центрами
Условно rм называют радиусом молекулы, а r0 - радиусом сферы молекулярного действия (rм≈10-8 см; r0≈10-6 см). Проведем вокруг какой-либо молекулы сферу радиусом r0. Центральная молекула притягивается ко всем молекулам, находящимся внутри этой сферы (рис. 10.2).

Рисунок 10.2 – Центральная молекула, находящаяся в центре сферы радиусом r0
Если в пределах сферы молекулярного действия плотность вещества одинакова, то равнодействующая сил притяжения, действующих на центральную молекулу, равна нулю. Если же плотность вещества неодинакова, то равнодействующая сил молекулярного притяжения не равна нулю и направлена в сторону большей плотности. Поэтому на каждую молекулу поверхностного слоя толщиной r0 действуют силы молекулярного притяжения, перпендикулярные поверхности и направленные в глубь жидкости (рис. 10.3). Под действием этих сил молекулы стремятся уйти с поверхности в глубину.
Вместе
с тем молекулы поверхностного слоя
обладают избытком потенциальной энергии
по сравнению с молекулами, находящимися
в г лубине
жидкости. Устойчивое равновесие жидкости
связано с минимумом потенциальной
энергии, т.е. с минимально возможной в
данном состоянии величиной поверхности
жидкости.
лубине
жидкости. Устойчивое равновесие жидкости
связано с минимумом потенциальной
энергии, т.е. с минимально возможной в
данном состоянии величиной поверхности
жидкости.
При изотермическом увеличении площади поверхности жидкости совершенная работа равна увеличению свободной поверхностной энергии, т.е.:
![]() ,
(10.1)
,
(10.1)
где ωS – свободная энергия одной молекулы на поверхности жидкости;
ωV - свободная энергия одной молекулы на глубине;
ΔN – число молекул, выведенных из глубины на поверхность жидкости.
Величина, численно равная работе изотермического увеличения поверхности жидкости на единицу, называется коэффициентом поверхностного натяжения, т.е.:
![]() .
(10.2)
.
(10.2)
Обозначим
![]() – изменение
свободной поверхностной энергии одной
молекулы, а
– изменение
свободной поверхностной энергии одной
молекулы, а
![]() – число молекул
единицы поверхности жидкости. Тогда
– число молекул
единицы поверхности жидкости. Тогда
![]() .
(10.3)
.
(10.3)
Между молекулами поверхностного слоя, как показывает опыт, действуют силы поверхностного натяжения, направленные по касательной к поверхности перпендикулярно любой линии на поверхности жидкости. Можно предполагать, что молекулы поверхностного слоя расположены на расстояниях, несколько больших 2rм (см. рис. 10.1), эти расстояния уменьшаются по мере удаления от поверхности и становятся несколько меньше 2rм на глубине h≥r0 (см. рис. 10.3).
Силы поверхностного натяжения – это силы взаимного притяжения молекул. Работу увеличения поверхности можно подсчитать, например, при увеличении поверхности мыльной пленки (рис. 10.4):
ΔA= - F1Δx, (10.4)
где F1
– внешняя сила, равная силе поверхностного
натяжения, действующей на всю границу
поверхности 2l,
но противоположно направленная:
![]() .
Здесь F
– сила поверхностного натяжения,
действующая на границу l.
Но у пленки две поверхности. Тогда
получим:
.
Здесь F
– сила поверхностного натяжения,
действующая на границу l.
Но у пленки две поверхности. Тогда
получим:
![]() .
(10.5)
.
(10.5)
К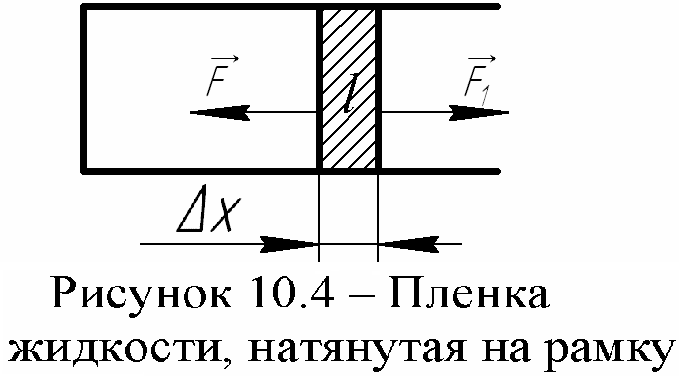 оэффициент
поверхностного натяжения измеряется
силой поверхностного натяжения,
действующей по касательной к поверхности
на единицу длины произвольного контура
на поверхности жидкости.
оэффициент
поверхностного натяжения измеряется
силой поверхностного натяжения,
действующей по касательной к поверхности
на единицу длины произвольного контура
на поверхности жидкости.
Увеличим площадь поверхности на ldх, тогда согласно формуле (10.5),
F = -σl. (10.6)
Это и есть сила, действующая на отрезок L рамки и обусловленная поверхностным натяжением. (Так как пленка имеет две стороны, то на отрезок рамки будет действовать сила, вдвое большая). Знак минус показывает, что эта сила направлена внутрь поверхности пленки.
Этот коэффициент зависит от рода жидкости, т.е. от соотношения свободной поверхностной энергии и энергии молекулы в глубине жидкости, а также от плотности жидкости, так как от нее зависит число молекул единицы поверхности. При нагревании жидкости уменьшается как Δω, так и n, поэтому коэффициент поверхностного натяжения также уменьшается.
Рассматривая молекулы поверхностного слоя, мы пренебрегли действием молекул из верхней части сферы молекулярного действия. Но по мере роста температуры растет плотность пара над поверхностью, а плотность жидкости даже уменьшается. Поэтому равнодействующая сил молекулярного притяжения, действующая на каждую молекулу поверхностного слоя, уменьшается. При критической температуре, когда исчезает различие между жидкостью и ее паром, эта равнодействующая обращается в нуль, исчезает поверхностный слой, обращается в нуль Δω и, следовательно, коэффициент поверхностного натяжения.
Ниже приведены значения коэффициента поверхностного натяжения при температуре 200 С для различных веществ.
Таблица 10.1 – Коэффициент поверхностного натяжения различных веществ
-
Вещество
σ, мН/м
Ртуть/пары
484
Вода/пары
73
Глицерин/пары
64
Нефть/вода
25-35
Итак, поверхностное натяжение при различии в межмолекулярных взаимодействиях в фазах, образующих поверхность раздела. Таким образом, необходимым и достаточным условием существования поверхности раздела, а, следовательно, и поверхностного натяжения, является во-первых, наличие сил притяжения между молекулами, приводящих к конденсации и, во-вторых, различие в величине этих сил в граничащих фазах.
С ростом температуры происходит уменьшение поверхностного натяжения вплоть до обращения его в нуль при критической температуре, где исчезает различие между жидкостью и паром. Величина поверхностного натяжения может сильно меняться при введении в жидкость примесей. Существует целый класс так называемых поверхностно активных веществ (ПАВ), способных адсорбироваться на поверхности раздела фаз с соответствующим понижением их поверхностного натяжения. Для воды такими веществами являются различные мыла.
Поверхностное натяжение на границе раздела нефть-вода в среднем порядка (0,025-0,035) Н/м. Для увеличения нефтеотдачи пластов часто требуется снизить межфазное натяжение. Эффективным методом является метод заводнения пластов растворами ПАВ или нагнетание в пласт щелочных вод. Они способствуют образованию натриевых мыл вблизи поверхности раздела вода-нефть и тем самым уменьшают поверхностное натяжение нефти на границе с водой. Введение в пласт углекислого газа СО2 (растворенного в воде или в жидком виде), при котором происходит взаимное растворение углекислоты в нефти, также приводит к снижению межфазного натяжения.
Если поверхность раздела фаз не плоская, то по обе стороны искривленной поверхности существует разность давлений, вызванная поверхностным натяжением. Это добавочное давление называется поверхностным или капиллярным давлением (Pпов).
В данной работе при опускании металлического кольца в воду, его стенки смачиваются водой. Между нижним краем кольца и опускающейся поверхностью воды образуется упругая водная пленка.
П ри
опускании чашки с водой пленка
растягивается, увеличивая свою
поверхность. Силы
поверхностного натяжения стремятся
уменьшить величину поверхности
растягиваемой пленки (рис. 10.5). Одновременно
они действуют на кольцо, оттягивая его
вниз, что и приводит к натяжению нити.
Сущность метода состоит в том, что, если
сила поверхностного натяжения F
в момент
отрыва кольца и сила натяжения нити mg
растягивают
ее до одной и той же длины, то они равны
между собой.
ри
опускании чашки с водой пленка
растягивается, увеличивая свою
поверхность. Силы
поверхностного натяжения стремятся
уменьшить величину поверхности
растягиваемой пленки (рис. 10.5). Одновременно
они действуют на кольцо, оттягивая его
вниз, что и приводит к натяжению нити.
Сущность метода состоит в том, что, если
сила поверхностного натяжения F
в момент
отрыва кольца и сила натяжения нити mg
растягивают
ее до одной и той же длины, то они равны
между собой.
Если D и d –наружный диаметры металлического кольца и его толщина, то длина границ пленки, равна πD+π(D – 2d).
Тогда величина силы поверхностного натяжения
![]()
Откуда
![]() (10.7)
(10.7)
(здесь σ – коэффициент поверхностного натяжения воды на границе с воздухом, определяемой в работе).
