
Опыт Резерфорда.
Эксперимент породил планетарное строение атома. Энергия в атоме, согласно классич представлению: T=mV2/r
U= - ke2/r (водород)
Полная энергия:
Сила: mV2/r = ke2/r2
ke2/r2 – Кулон
mV2= ke2/r
T= ke2/2r
Еполн= T+U= ke2/2r - ke2/r = -ke2/r

Энергия электрона имеет непрерывный спектр в зависимости от r.
В эксперименте наблюдается дискретный спектр излучения – несоответствие.
При вращении эл-на по орбите он имеет нормальное ускорение aн. Заряженная частица, движущаяся с ускорением по классич термодинамике излучает энергию, те её энергия уменьшается и тогда эл-он должен приближаться к ядру и рано или поздно на него упадёт – 2 несоответствие.
Вопрос№6
Для того, чтобы спасти эксперимент и модель, Бор сформировал 2 постулата:
1.Среди всевозможных орбит, по которым могут двигаться электроны вокруг ядра в атоме,
существуют такие, находясь на которых электрон не излучает энергию. Такие орбиты называются стационарными.
2.При переходе из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией, электрон излучают энергию: hυ=Ei-Ej
Среди всех стационарных орбит у электрона есть одно основное состояние, в котором он может находиться сколь угодно долго – это состояние с наименьшей энергией. Все остальные стационарные состояния отличаются тем, что электрон в этом состоянии может находиться очень недолго (~10-8 сек) и переходит в другое стационарное состояние с меньшей энергией.
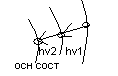
Такие состояния называются возбуждёнными при воздействии на атом (Эл-он) внешними источниками энергии они переходят в возбуждённое состояние из основного.
Для своей теории Бор использовал положение Планка о том, что состояние гармонического осциллятора дискретны, т.е электрон, как гармонический осциллятор в стационарном состоянии должен обладать энергией величина которой кратна hυ.
E=nћω
υ= ω/2π
h/2π = ћ
полная энергия: E=T+U
E=p2/2m + mω2x2/2
mω2x2/2 + p2/2m = nћω
Введём обобщённые координаты:
q-обобщ коорд
p-обобщ импульс
Обобщёнными координатами называются любые величины, с помощью которых может быть задано состояние частицы.
mω2q2/2 + p2/2m = nћω
q2/(2nћ/mω) + p2/2mnћω = 1
В координатах, которые образуют фазовую плоскость это выражение эллипс с полуосями
a=√(2πn/mω)
b=√(2mnћω)

фазовая траектория микрочастиц в атоме
p=f(q)
Площадь эллипса Sn=∫pdq
Sn=π√(2πn/mω) * √(2mnћω) = 2πnћ
pL
qφ
Sn=L∫dφ=2πL
L=Jω
ω – угловая скорость движения
L=mer2ω=meVr
2πL=2πnћ
meVr = nh – условие квантования стациона. Орбит
Момент импулься квантуется.
Теория Бора: (для водорода)
Классич мех: mV2/r = kZe2/r2
Квантовая физика: meVr=nћ
Rn=n2ћ2/ke2m
Радиус стац орбит электронов в водороде имеет дискретный ряд значений (кратен n2)
В основном состоянии радиус орбиты электрона = r0 – 2r0 – размер атома водорода, что точно совпало с эксперимент данными, полученными физико-химических экспериментов молек физики.
Энергия электронов в атоме водорода.
E= - ke2/r
En = - k2me4/n2ћ2
Энергия имеет дискретный ряд значений.
n=1
E1=E0= - k2me4/h2 = -13,53 (эВ)
Экспериментально было получено: Eион=13,53 (эВ)
Eион=Е∞ - Е0 = -13,53 (эВ)
Теория совпала с экспериментом.
Формула Бальмера:
hυ = Ei-Ej
Ei= - k2me4/ni2ћ2
Ej= - k2me4/nj2ћ2
υ = Rc (1/nj2 – 1/ni2)
Теория Бора оказалась промежуточным этапом между классич и квантовой механикой.
Недостатки:
1.Была полуклассич, полуквантовой
2.Не объясняет различие интенсивности спектральных линий разной частоты
3.Непременима к более сложным чем водород атомам
4.В спектрах многих элементов наблюдаются дуплеты – двойные линии.
Тем не менее предполож Бора о том, что состояние атомов имеет дискретный ряд значений подтвердились в опытах Франка-Герца. Они рассматривали процесс взаимодействия электронов с атомами различ элементов методом задерживающего потенциала

При увеличении U электроны начинают двигаться к аноду, но при знач < 0,5 В эти электроны задерживаются сеткой – энергия мала. Тока в цепи нет. По мере увелич напряж электроны имеют энергию достаточную для преодаления пр-ва. В цепи появляется ток, который растёт в связи с приближением. Так продолжается до U=4,9 В. После чего ток в цепи резко уменьшается. При U=5,4 В ток снова увеличивается и уменьшается после 9,8 В. И т.д.
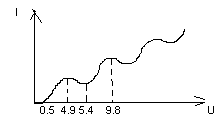
Это обусловлено тем, что электроны испытывают упр и неупр столкновения с атомами ртути. При упр соударениях энергия Эл-нов не изменяется. При неупр – они отдают энергию атомам.
На участке 0-0,5 В энергии недостаточно для достижения анодов. Их задерживает потенциал сетки = -0,5 В. На усастке 0,5-4,9 В – Эл-ны испытывают упр соударения с атомами ртути, их энергия увеличивается, они не передают эн атомов ртути и достигают анода. На участке 4,9-5,4 В – часть Эл-нов испытывает неупр соударения с атомами ртути. Передают энергию 4,9 эВ атомам ртути, переводя их в возбужд состояние и не достигают анода, и т.д.
Атом может поглащать или принимать энергию только порциями, кратными 4,9 эВ. Была подтверждена теория идея Бора о том, что процесс поглащ и испускания атомов энергии происходит порциями, дискретно.
Вопрос№7.
Исходные предпосылки возникновения квантовой механики.
1) Двойная природа света
Свет – волна(,,)
Свет – частица(E, p)
E = h; E = ħ
P = h = h/(2*c); p = ħk
h = mc2
p = h/
p = ħ2/ = ħk
= c/; ħ = h/2
2) противоречивость теории Бора в которой использованы формула классической механики и ф-ла выражающая квантование(так же теория Бора необъясняет различия спектральных линий разных частот, не применима к к более сложным чем водород атомам, в спектрах многих Эл-тов наблюдаются дублеты, причём теорию появления дублетов теория Бора не объясняет)
Гипотеза де Бройля
Де Бройль предположил, что не только свет, но и любая частица, масса покоя которой не равна 0, обладает также и волновыми свойствами, которые для опр. Частиц и в опр. Условиях могут проявиться.
p = h/ ; = h/mV
Экспериментальное подтверждение гипотезы де Бройля
В 1927 году американские физики К. Дэвиссон и Л. Джермер подтвердили гипотезу Бройля экспериментами, в которых поток электронов, укоренный разностью потенциалов V, направляли на поверхность кристалла никеля. И исследовали зависимость интенсивности отражённых электронов от угла отражения и от приложенного к электронной пушке напряжения V. Дифракционные максимумы соответствовали ф-ле Вульфа – Брэггов 2dSin = m, а брэгговская длинна волны оказалась в точности равной длине волны = h/p

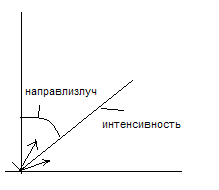
Полное совпадение эксперимента с теорией(т.е. с формулой)
Исследование зависимости максимума интенсивности Эл-трона если = const
I = f(V 0,5)
2dSin = m - формула Вульфа - Брэггов
2dSin = m*12,25*10-10*V0.5
m V0.5

