
- •Расчетно-графические работы
- •Задание № 1 Первое начало термодинамики Закон Гесса. Уравнение Кирхгофа.
- •Задание № 2 Второе начало термодинамики. Энтропия.
- •Термодинамические потенциалы
- •Задание № 3 Фазовое равновесие в однокомпонентных системах
- •Задание 4 Химическое равновесие
- •Задание 5 Термодинамика растворов Расчет термодинамических функций в двухкомпонентных системах
- •Задание 7 Равновесие жидкость – пар в бинарных жидких системах
- •Задание 8 Равновесие твердых и жидких фаз в двухкомпонентных системах
Задание № 2 Второе начало термодинамики. Энтропия.
1. Напишите математическое выражение 2-го закона термодинамики в дифференциальной форме для обратимого (равновесного) и необратимого процессов в открытой системе.
2. Энтропия как критерий состояния равновесия и направления протекания самопроизвольного процесса в изолированной системе. Приведите соответствующие выражения 2-го закона термодинамики.
3. Напишите уравнения, выражающие зависимость энтропии от температуры ( ) и давления ( ), и проанализируйте их. Приведите уравнения для расчета изменения энтропии в изобарном, изохорном и изотермическом процессах с участием идеального двухатомного газа.
4.
Рассчитайте изменение энтропии (![]() )
вещества А
(см. задание 1) при изобарном нагревании
от 298 до 800 K
в
)
вещества А
(см. задание 1) при изобарном нагревании
от 298 до 800 K
в
![]() .
(Принять, что вещество А находится
в газообразном состоянии, используйте
уравнение
.
(Принять, что вещество А находится
в газообразном состоянии, используйте
уравнение
![]() (см. задание 1, п.12).
(см. задание 1, п.12).
5.
На основании уравнения зависимости
теплоемкости от температуры
(см. задание 1, п.12)
для вещества
А в газообразном
состоянии рассчитайте
значения
теплоемкости
![]() при температурах
298, 400, 500, 700, 800 и 1000 K.
при температурах
298, 400, 500, 700, 800 и 1000 K.
6.
Постройте график зависимости
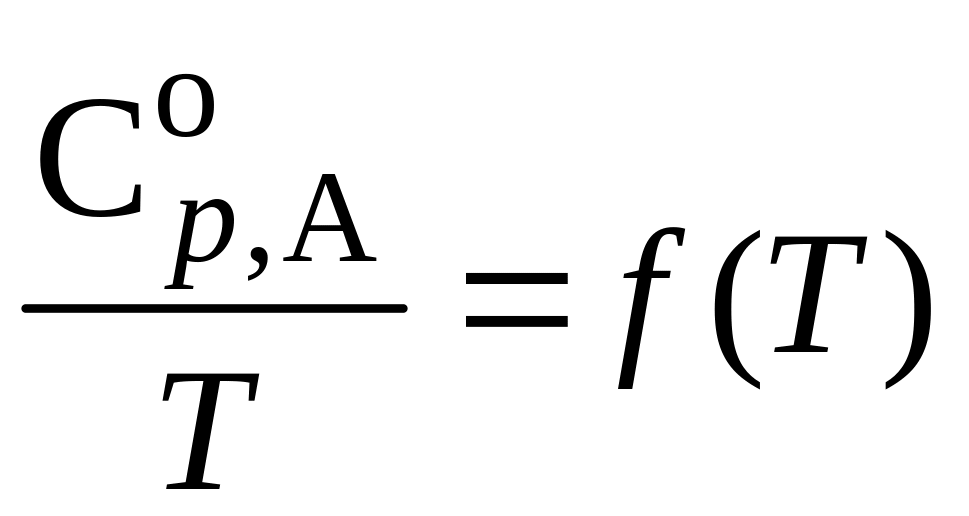 для вещества А
в газообразном состоянии на основании
значений теплоемкостей, рассчитанных
в п.3.
для вещества А
в газообразном состоянии на основании
значений теплоемкостей, рассчитанных
в п.3.
7. Графическим интегрированием определите изменение энтропии вещества А при изобарном нагревании от 298 до 800 K в .
8.
Определите абсолютную энтропию
![]() вещества A
на основании значения
вещества A
на основании значения
![]() [7]
и
.
[7]
и
.
9.
Определите изменение энтропии (![]() )
вещества А
в
в процессе изменения давления от
)
вещества А
в
в процессе изменения давления от
![]()
![]() Па до
Па до
![]() Па при температуре
800 K,
полагая вещество А идеальным газом.
Па при температуре
800 K,
полагая вещество А идеальным газом.
10.
Определите абсолютную энтропию вещества
А в
при 800 К и давлении
![]() .
.
11.
Определите изменение энтропии (![]() )
для реакции А
(см. задание 1), протекающей при 298 К и
стандартном давлении.
)
для реакции А
(см. задание 1), протекающей при 298 К и
стандартном давлении.
Термодинамические потенциалы
12. Укажите при
каких условиях проведения процесса
![]() и
и
![]() служат
критериями состояния равновесия и
направления самопроизвольного протекания
процесса. Приведите соответствующие
выражения.
служат
критериями состояния равновесия и
направления самопроизвольного протекания
процесса. Приведите соответствующие
выражения.
13. Напишите
уравнение, выражающее зависимость
энергии Гиббса от давления и температуры
в дифференциальной форме. Приведите
графические зависимости
![]() при
и
при
и
![]() при
.
при
.
14. Приведите
уравнения для расчета изменения энергии
Гиббса при изотермическом расширении
от давления
![]() до
и изобарном нагревании от
до
и изобарном нагревании от
![]() до
до
![]() 1 моль газа в идеальном состоянии.
1 моль газа в идеальном состоянии.
15. Рассчитайте
изменение энергии Гиббса (![]() )
при изобарном нагревании (
)
при изобарном нагревании (![]() )
1 моль вещества А, находящегося в
идеальном газообразном состоянии, от
)
1 моль вещества А, находящегося в
идеальном газообразном состоянии, от
![]() до
до
![]() в
в
![]() (принять, что в интервале температур
298 – 800 K энтропия не зависит
от температуры и равна
(принять, что в интервале температур
298 – 800 K энтропия не зависит
от температуры и равна
![]() ).
).
16. Рассчитайте
изменение энергии Гиббса (![]() )
в процессе изотермического расширения
1 моль вещества А, находящегося в
идеальном газообразном состоянии, от
давления
Па до
)
в процессе изотермического расширения
1 моль вещества А, находящегося в
идеальном газообразном состоянии, от
давления
Па до
![]() Па при температуре 800 К в
.
Па при температуре 800 К в
.
17. Определите ΔG для 1 моль вещества А, находящегося в идеальном газообразном состоянии, при изменении давления от Па до и одновременном изменении температуры от 298 до 800 К в кДж/моль.
18. Определите
![]() в кДж для реакции А (см. задание 1),
протекающей при 298 оК и стандартном
давлении и сделайте вывод о направлении
протекания данной химической реакции.
в кДж для реакции А (см. задание 1),
протекающей при 298 оК и стандартном
давлении и сделайте вывод о направлении
протекания данной химической реакции.
19. Определите
![]() в кДж для реакции А (см. задание 1),
протекающей при 298 оК и
в кДж для реакции А (см. задание 1),
протекающей при 298 оК и
![]() и сделайте вывод о направлении протекания
реакции.
и сделайте вывод о направлении протекания
реакции.
20. С помощью метода
Темкина–Шварцмана рассчитайте изменение
энергии Гиббса данной реакции А при
800 K (![]() ).
).
Если Вы затрудняетесь выполнить это задание, то обратитесь к литературе [9], с. 69 - 93, примеры 5,6,7,16,17,18,20 (задачи с решениями).
