
- •Химическое отделение вятский государственный гуманитарный университет
- •М. А. Зайцев, о. В. Огородникова теория электролитической диссоциации
- •2. Механизм электролитической диссоциации веществ с различным типом химической связи
- •2.1. Диссоциация веществ с ионной структурой
- •2.2. Диссоциация электролитов, состоящих из полярных молекул
- •2.3. Гидраты. Кристаллогидраты
- •3. Свойства ионов
- •4. Степень диссоциации
- •5. Равновесия в растворах электролитов
- •5.1. Равновесия в растворах слабых и средних электролитов
- •5.2. Равновесия в растворах сильных электролитов
- •6. Электролитическая диссоциация воды (самоионизация). РН
- •Некоторые кислотно-основные индикаторы
- •7. Буферные системы
- •Значения рН некоторых объектов
- •8. Теории кислот и оснований
- •8.1. Диссоциация кислот и оснований в воде
- •8.2. Обобщенные теории кислот и оснований
- •8.2.1. Теория сольвосистем (сольвентная теория)
- •8.2.2. Протонная (протолитическая) теория
- •8.2.3. Электронная теория (теория Льюиса)
- •9. Ионные процессы
- •10. Гидролиз солей
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Литература
- •Краткие биографические сведения об ученых
2.1. Диссоциация веществ с ионной структурой
Когда кристалл соли, например, хлорида натрия NaCl, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам натрия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам – положительными. Но если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают «толчки» со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор в гидратированном виде (рис. 1). Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
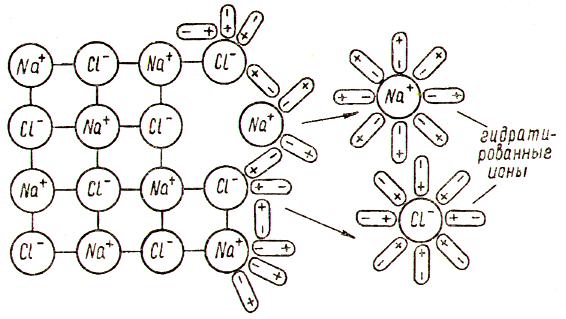
Рис. 1. Диссоциация вещества с ионной структурой
2.2. Диссоциация электролитов, состоящих из полярных молекул
При попадании полярной молекулы (например, хлороводорода НСl) в воду молекулы воды притягиваются к полюсам полярной молекулы (диполь-дипольное взаимодействие) и вызывают расхождение ее полюсов – дополнительно поляризуют молекулу. В результате связь из ковалентной полярной превращается в ионную, и дальше молекула диссоциирует по типу ионного кристалла. Как и в случае ионного кристалла образующиеся ионы гидратируются (рис. 2).
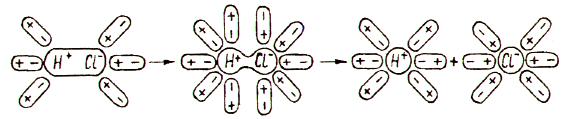
Рис. 2. Диссоциация электролита, состоящего из полярных молекул
Таким образом, главной причиной диссоциации в водных растворах является взаимодействие электролитов с водой и гидратация ионов.
2.3. Гидраты. Кристаллогидраты
В растворах электролитов все ионы находятся в гидратированном состоянии, образуют гидраты.
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но некоторые ионы образуют с молекулами воды достаточно прочные гидраты. Например, ионы водорода соединяются с молекулами воды и образуют ионы гидроксония по донорно-акцепторному механизму:
Н+ + Н2О Н3О+.
Иногда гидраты настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Состав кристаллогидратов изображают формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат, например:
CuSO45Н2О – медный купорос;
FeSO47Н2О – железный купорос;
Na2SO410Н2О – глауберова соль;
CaSO42Н2О – гипс;
Na2В4О710Н2О – бура;
KAl(SO4)212Н2О – алюмокалиевые квасцы.
Обратите внимание! Точка в формуле кристаллогидрата не является знаком умножения, поэтому при чтении формул не нужно употреблять предлог «на». Например, формула гипса читается так: кальций-эс-о-четыре два аш-два-о.
При вычислении молярной массы кристаллогидрата производят сложение молярной массы безводного вещества и обозначенного коэффициентом числа молярных масс воды. Например:
М(CaSO42H2O) = M(CaSO4) + 2M(H2O) = 136 + 218 = 172 (г/моль).
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре. Так, прозрачные кристаллы соды (Na2СО310Н2О) легко «выветриваются» – теряя кристаллизационную воду, становятся тусклыми и постепенно рассыпаются в порошок. Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание.
