
- •Низкотемпературная сепарация газа
- •11.1.1 Требования на качество сухого газа
- •11.1.2 Требования на конденсат
- •Эксплуатация промысловой дкс характеризуется
- •Требования к газоперекачивающим агрегатам
- •2 Схемы сбора и внутрипромыслового транспорта газа и конденсата
- •Расчет пластового и забойного давления в газовой скважине
- •Эксплуатация скважин при пескопроявлении
- •Удаление жидкости из скважины
- •Размещение скважин по структуре газоносности
- •Исходные данные для составления проекта разработки:
- •Опасные свойства природного газа
- •Тепловые свойства природных газов
- •Вязкость природного газа
- •Обобщенный закон Клайперона – Менделеева – уравнение состояния идеальных газов.
- •Состав и классификация природных газов
- •Преимущества природного газа, как топлива и сырья для химической промышленности.
Тепловые свойства природных газов
Теплоемкость природного газа
Удельной теплоемкостью называется количество теплоты, которое необходимо подвести к единице массы вещества, чтобы изменить его температуру на 1 градус.
Для газов различают удельные теплоемкости: изобарную ср (р=const) и изохорную сv (v=const)
Изобарная молярная теплоемкость природных газов определяется по формуле:
ср0=0,523(8,36+0,00892t)Мi3/4,
 (2.10)
(2.10)
где t-температура, С; Мi-молекулярная масса I-го компонента природного газа.
Тогда для смеси газов формула (17) преобразуется следующим образом:
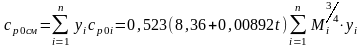 ,
(2.11)
,
(2.11)
где yi-молярная доля I-го компонента в смеси, срi-изобарная молярная теплоемкость I-го компонента.
Изобарная молярная теплоемкость реальных природных газов зависит от давления и от температуры ср=ср0(t)+cp(P,t), (2.12)
где cp(P,t)-изотермическая поправка теплоемкости на давление, ее можно определить по номограмме в зависимости от приведенных параметров.
Для приближенных расчетов при 0,02≤Рпр≤4, 1,3≤Тпр≤2,5
c0=32,600Рпр/Тпр4 кДж/(кмоль∙К) (2.13)
Теплоемкость неуглеводородных компонентов (N2, H2S и СО2) примерно равна 0,5 теплоемкости углеводорода с одинаковой молярной массой.
Теплотоворная способность или теплота сгорания – количество тепла, выделяемое при сгорании при определенных условиях (чаще всего при Р=0,013 МПа и Т=288К). Единицы измерения - МДж/кг, МДж/м3 (ккал/кг, ккал/м3). Различают высшую и низшую теплоту сгорания. Для получения низшей теплоты сгорания из высшей вычитают тепло, расходуемое на испарение гигроскопической воды. Присутствие в смеси инертных газов понижает теплоту сгорания. При сгорании 1кг каменного угля выделяется 9 ккал, 1кг нефти – 11 ккал, 1м3 газа - 7 ккал.
Дросселирование– расширение газа при прохождении через дроссель — местное гидравлическое сопротивление (вентиль, кран, сужение трубопровода и т.д.), сопровождающееся изменением температуры. Дросселирование – термодинамический процесс, характеризующийся постоянством энтальпии (i = const). В процессе дросселирования реального природного газа при его движении через штуцер, задвижку, регулятор давления, клапан-отсекатель, колонны труб в скважине, неплотности в оборудовании промыслов уменьшается температура газа.
Изменение температуры газов и жидкостей при изоэнтальпийном расширении называется эффектом Джоуля-Томсона или дроссель-эффектом, а Diчасто называют коэффициентом Джоуля-Томсона.
Di = (Т/р)i= [T (V/Т)p –V]/сp, илиDi = Т/ Р, (2.14)
где Т – изменение температуры, а Р- изменение давления. Среднее значение коэффициента Джоуля—Томсона для природного газа изменяется от 2 до 4 К/МПа в зависимости от составагаза, падения давления и начальной температуры газа. Для приближенных расчетов среднее значение коэффициента Джоуля—Томсона можно принимать равным 3 К/МПа. У жидкостей Di, <;0, поэтому при дросселировании они нагреваются. Для наибольшего снижения температуры газа в штуцере необходимо удалять жидкость из газового потока до его поступления в штуцер.Среднее значение коэффициента Джоуля—Томсона для нефти изменяется от 0,4 до 0,6 К/МПа, для воды оно составляет 0,235 К/МПа.
Как определить плотность и относительную плотность природного газа?
1 Плотность газа0 в нормальных физических условиях (Р0-0,1013 МПа и Т0=273 К) можно определить по формуле:
 , (2.1)
, (2.1)
где М - молекулярная масса.
Если задана плотность газа при нормальных условиях (н.у.), можно определить относительную плотность газа, как отношение плотности газа к плотности воздуха (плотность воздуха при н.у. равна 1,293 кг/м3):
 . (2.2)
. (2.2)
Коммерческие расчеты в газовой промышленности проводят при стандартных условиях (Рст=0,1013 МПа, Тст=293 К). В некоторых странах, в т. ч. в США Тст принята равной 288 К (15С).
Природные газы представляют собой смесь компонентов, поэтому если известен молярный состав смеси в процентах, то среднюю молекулярную массу вычисляют по формуле:
 (2.3)
(2.3)
где у1, у2,…,уn-молярные (объемные) доли компонентов, %; М1, М2,…, Мn-молекулярные массы компонентов.
Плотность
природного газа при заданном давлении
и температуре определяется по формуле:
 , (2.4)
, (2.4)
где
0
-
плотность газа при нормальных условиях
–н.у. (Р0=0,1013
МПа; Т0=273
К); z0,
z-коэффициенты
сверхсжимаемости при н.у. и при заданных
условиях.Коэффициент
сверхсжимаемости характеризует
отклонение реального газа от законов
идеального газа. При н.у. z0 1.
1.
Плотность углеводородного конденсата
Если дан массовый или молярный состав газа, то содержание в нем тяжелых углеводородов (пропановой фракции, бутановой фракции и газового бензина) определяется по формуле: А= 10 gсм =10у, (2.5 )
где g –массовое содержание данного тяжелого углеводорода в газе, %; см – средняя плотность природного газа (смеси газов), кг/м3; у – молярное содержание данного тяжелого компонента в газе; - плотность данного тяжелого компонента, кг/м3. Считают, что в газовый бензин целиком переходит пентан плюс вышекипящие и часть нормального бутана.
Средняя плотность жидкой смеси определяется по формуле:
 , (2.6)
, (2.6)
где g- массовое содержание компонентов жидкой смеси, %; М – молекулярные массы компонентов; - плотности компонентов жидкой смеси, кг/м3.
Что такое вязкость природных газов и как она зависит от давления, температуры и состава газа? Какие существуют методы определения вязкости природных газов?
