
- •Методичні вказівки для самостійної роботи студентів денної і заочної форми навчання з навчальної дисципліни „ Теплотехніка.”
- •Передмова
- •1 Програма з навчальної дисципліни „ Теплотехніка”
- •1 Мета та завдання дисципліни
- •1.1 Мета викладання дисцип
- •2.3 Основи теорії теплообміну.
- •Модуль 2
- •2.4 Системи теплопостачання харчових виробництв та охорона навколишнього середовища
- •Перелік літератури Основна
- •Додаткова.
- •Критерії успішності навчання
- •2 Рівняння стану ідеального газу. Перший та другий закони термодинаміки
- •3 Основні процеси ідеальних газів
- •Запитання до самоконтролю і повторення
- •Приклади розв'язування задач
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Задачі для самостійного розв'язування
- •4 Основні закони суміші ідеальних газів
- •Запитання до самоконтролю і повторення
- •Приклади розв'язування задач
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Задачі для самостійного розв'язування
- •5 Водяна пара
- •Запитання для самоконтролю і повторения
- •Приклади розв'язування задач
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Задачі для самостійного розв'язування
- •6 Цикли теплових та холодильних машин
- •1. Двигуни виутрішнього згоряння (двз)
- •Цикл Отто:
- •Цикл Дизеля:
- •Цикл Тринклсра:
- •2. Газотурбіна установка (гту)
- •3. Повітряна холодильна установка
- •Приклад розв'язання задач
- •Розв'язання
- •Задачі для самостійного розв'язування
- •7 Теплопередача
- •Запитання для самоконтролю і повторення
- •Прикладн розв'язування задач
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Задачи для самостійного розв'язування
- •Додатки
3 Основні процеси ідеальних газів
Основними термодинамічними процесами є ізохорний (що відбуваеться при сталому об'ємі V=const), ізобарний (при сталому тиску Р=const), ізотермічний (при сталій температурі Т=const), адіабатний (без теплообміну з навколишшми тілами). Всі ці процеси є окремі випадки політропного процесу.
Рівняння політропного процесу
р∙vn =const, (2)
де показник політропи:
![]() .
.
При n=±∞ ![]() -процес
ізохорний,
-процес
ізохорний,
n=0 ![]() -процес ізобарний,
-процес ізобарний,
n=1 ![]() -процес ізотермічний,
-процес ізотермічний,
n=k ![]() -процес адіабатний.
-процес адіабатний.
Діаграми цих процесів зображено на рисунку:
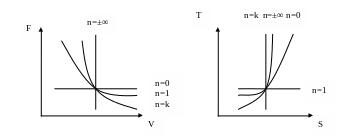
Залежність між параметрами стану в політропному процесі:
Зміна внутрішньої енергії^
![]() .
(3)
.
(3)
Робота процесу
![]() ,
(4)
,
(4)
або
![]() .
(5)
.
(5)
Теплоємність
![]() .
(6)
.
(6)
де показник адіабатики:
![]() .
(7)
.
(7)
Теплота:
![]() .
(8)
.
(8)
Зміна ентропії:
![]() .
(9)
.
(9)
Рівняння адіабатного процесу
pVk=const, (10)
де показник адіабати
![]() .
(11)
.
(11)
Залежність між параметрами стану в адіабатному процесі:
 ;
(12)
;
(12)
 ;
(13)
;
(13)
 .
(14)
.
(14)
Зміна внутрішньої енергії:
![]() .
(15)
.
(15)
Робота процессу:
![]() ,
(16)
,
(16)
або
. (17)
Теплоемність, кількість теплоти та зміна ентропії в адіабатному процесі дорівнюють нулю.
Рівняння ізохорного процессу:
V= const. (18)
Залежність між параметрами стану:
![]() .
(19)
.
(19)
Зміна внутрішньої енергії:
![]() .
(20)
.
(20)
Робота дорівнює 0.
Теплоемнють:
![]() ,
(21)
,
(21)
де і - ступень вільності газу (для одноатомних газів і = 3; для двохатомних газів і = 5; для багатоатомних газів і = 6).
Питома газова стала:
![]() [Дж/(кг
К)];
(22)
[Дж/(кг
К)];
(22)
Універсальна газова стала:
![]() (Дж/
моль К ];
(23)
(Дж/
моль К ];
(23)
µ - молярна маса газу [ кг / моль ].
Теплота процессу:
![]() .
(24)
.
(24)
Зміна ентропії:
![]() .
(25)
.
(25)
Рівняння ізобарного процессу:
р=const. (26)
Залежність між параметрами стану:
![]() .
(27)
.
(27)
Зміна внутрішньої енергії:
![]() .
(28)
.
(28)
Робота процессу:
![]() ,
(29)
,
(29)
або
![]() .
(30)
.
(30)
Теплоємність:
![]() [Дж/кгК].
(31)
[Дж/кгК].
(31)
Теплота процессу:
![]() .
(32)
.
(32)
Змінення ентропії:
![]() .
(33)
.
(33)
Рівняння ізотермічного процессу:
pv=const. (34)
Залежність між параметрами стану:
![]() .
(35)
.
(35)
Зміна внутрішньої ентропії:
![]() .
(36)
.
(36)
Робота процессу:
![]() ,
(37)
,
(37)
або
![]() ,
(38)
,
(38)
або
![]() .
(39)
.
(39)
Теплоємність:
с=∞. (40)
Кількість
теплоти дорівнює
роботі
процесу (тому що
![]() )
q=1.
)
q=1.
Зміна ентропії:
![]() .
(41)
.
(41)
