
- •Неорганическая химия биогенных элементов
- •Содержание
- •Введение
- •1 Понятие о биогенных элементах. Прогноз свойств химических элементов в зависимости от их положения в периодической системе
- •1.1 Биогенные элементы
- •1.2 Строение атома и Периодическая система химических элементов
- •1.3 Элементы первого периода (h, He)
- •1.4 Элементы второго периода (Li–Ne)
- •1.5 Элементы III периода (Na–Ar)
- •1 .6 Элементы IV периода (k–Kr)
- •1.7 Элементы V, VI и VII периодов
- •1.8 Прогнозирование свойств элементов, простых веществ и соединений
- •1.9 Образование химических связей
- •2 Кислотно-основные свойства соединений. Сравнение гидролизуемости солей
- •3 Комплексные соединения
- •3.1 Понятие о комплексных соединениях
- •3.2 Номенклатура комплексных соединений
- •3.3 Диссоциация комплексных соединений в растворах
- •3.4 Образование и разрушение комплексов
- •4 Окислительно-восстановительные реакции
- •4.1 Степени окисления атомов
- •4.2 Окислители
- •4.3 Восстановители
- •4.4 Окислительно-восстановительная двойственность
- •4.5 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •5 Расчёт концентраций ионов в насыщенных растворах соединений биогенных элементов. Возможность осаждения ионов из раствора в обменной реакции
- •5.1 Произведение растворимости
- •5.2 Определение возможности выпадения осадка малорастворимого электролита в обменной реакции
- •6 Расчёт pH в растворах кислот и оснований. Расчёт концентраций кислот и оснований по pH
- •Примеры задач на сильные электролиты
- •Примеры задач на слабые электролиты
- •Список литературы
1.3 Элементы первого периода (h, He)
В![]() атоме
водорода (Z = +1) единственный электрон
находится на самом низком из возможных
энергетических уровней: n = 1, который
образован одной s-орбиталью.
Электронно-графическая схема атома
водорода:
атоме
водорода (Z = +1) единственный электрон
находится на самом низком из возможных
энергетических уровней: n = 1, который
образован одной s-орбиталью.
Электронно-графическая схема атома
водорода:
Э![]() лектронная
формула атома водорода 1s1
показывает, что на
лектронная
формула атома водорода 1s1
показывает, что на
s-орбитали первого энергетического уровня находится 1 электрон.
В атоме гелия (Z = +2) два электрона, которые находятся
также на 1s орбитали. Электронно-графическая схема атома гелия:
Электронная формула атома гелия – 1s2 (на s-орбитали первого энергетического уровня находятся 2 электрона).
1.4 Элементы второго периода (Li–Ne)

У следующего за гелием элемента лития (Z = +3) третий электрон уже не может разместиться на первом энергетическом уровне, т.к. как на одной орбитали не может находиться более двух электронов. Поэтому третий электрон должен располагаться на втором энергетическом уровне n = 2.
С начала
заполняется более низкая по энергии
орбиталь.
Поэтому третий электрон в атоме лития
располагается на
2s-орбитали, так как
2s-орбиталь имеет более низкую энергию,
чем
2p-орбиталь. Полная электронная
формула атома лития: 1s22s1.
Очень часто, записывая электронную
формулу и электронно-графическую схему,
указывают только орбитали внешнего
энергетического уровня. Такие электронные
формулы и электронно-графические схемы
называются сокращёнными. Сокращённая
электронная формула атома лития 2s1,
сокращённая электронно-графическая
схема:
начала
заполняется более низкая по энергии
орбиталь.
Поэтому третий электрон в атоме лития
располагается на
2s-орбитали, так как
2s-орбиталь имеет более низкую энергию,
чем
2p-орбиталь. Полная электронная
формула атома лития: 1s22s1.
Очень часто, записывая электронную
формулу и электронно-графическую схему,
указывают только орбитали внешнего
энергетического уровня. Такие электронные
формулы и электронно-графические схемы
называются сокращёнными. Сокращённая
электронная формула атома лития 2s1,
сокращённая электронно-графическая
схема:
Электронную конфигурацию атома следующего за литием элемента бериллия (Z = +4) отражает сокращённая электронная формула 2s2. Сокращённая электронно графическая схема атома Be:
Э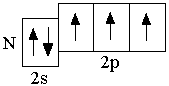 лементы,
в атомах которых электронами заполняются
s-орбитали, называются s-элементами (т.е.
H, He, Li, Be – это s-элементы).
лементы,
в атомах которых электронами заполняются
s-орбитали, называются s-элементами (т.е.
H, He, Li, Be – это s-элементы). Следующие за бериллием элементы второго
периода – бор, углерод, азот, кислород,
фтор, неон – являются p-элементами: у
них происходит заполнение электронами
p-орбиталей. Ниже представлены
сокращённые электронно-графические
схемы и сокращённые электронные формулы
этих элементов.
Следующие за бериллием элементы второго
периода – бор, углерод, азот, кислород,
фтор, неон – являются p-элементами: у
них происходит заполнение электронами
p-орбиталей. Ниже представлены
сокращённые электронно-графические
схемы и сокращённые электронные формулы
этих элементов.


B 2s22p1 C 2s22p2 N 2s22p3



O 2s22p4 F 2s22p5 Ne 2s22p6
При записи сокращённых электронных формул важно понимать, что число электронов на внешнем энергетическом уровне атомов s- и p-элементов равно номеру группы.
1.5 Элементы III периода (Na–Ar)
Электронная конфигурация внешнего энергетического уровня атомов элементов III периода аналогична электронной конфигурации атомов элементов II периода. Различие состоит лишь в том, что у элементов III периода заполняются орбитали третьего энергетического уровня (n = 3), который образован одной s-орбиталью, тремя p-орбиталями, пятью d-орбиталями:
элемент второго периода элемент третьего периода


У атомов всех элементов III периода, находящихся в невозбуждённом состоянии, 3d-орбитали являются вакантными (т.е. незаполненными электронами). Невозбуждённое (основное) состояние атома – это такое состояние, в котором каждый электрон занимает орбиталь с минимально возможной энергией. В возбуждённом состоянии электрон занимает орбиталь с более высокой энергией, хотя мог бы находиться на орбитали с более низкой энергией:
невозбуждённое состояние возбуждённое состояние
Анализируя
число неспаренных электронов в атоме,
можно спрогнозировать его валентность:
атом фосфора может быть как трёхвалентным
(3 неспаренных электрона в основном
состоянии), так и пятивалентным (в
возбуждённом состоянии).
Теоретически, на 9 атомных орбиталях третьего энергетического уровня могли бы разместиться 18 электронов. Но на практике на внешнем энергетическом уровне любого атома не бывает более 8 электронов. Таким образом, все восьмиэлектронные конфигурации ns2np6 являются завершёнными. Несмотря на то, что у атома аргона есть свободные 3d-орбитали, их заполнение происходит только в следующем четвёртом периоде.
