- •IV. Теория термодинамических потенциалов
- •34. Якобианы. Свойства
- •35. Якобиан преобразования (t, s) →(p, V)
- •36. Общее представление о термодинамических потенциалах
- •37. Внутренняя энергия как термодинамический потенциал
- •38. Преобразование Лежандра. Энтальпия
- •39. Свободная энергия. Уравнение Гиббса–Гельмгольца
- •40. Термодинамический потенциал Гиббса
- •41. Одно замечание о термодинамических функциях
- •42. Метод термодинамических потенциалов. Примеры применения
- •43. Термодинамические коэффициенты
- •44. Термодинамические потенциалы сложных систем
- •V. Термодинамика различных физических систем
- •45. Упругие стержни
- •46. Обратимый гальванический элемент
- •47. Равновесное излучение
- •VI. Процесс Джоуля–Томсона. Третье начало термодинамики
- •48. Термодинамика газа Ван-дер-Ваальса
- •49. Теория процесса Джоуля–Томсона
- •50. Третье начало термодинамики (теорема Нернста)
- •VII. Условия равновесия и устойчивости термодинамических систем
- •51. Неравновесные состояния. Виртуальные изменения
- •52. Экстремальные свойства термодинамических потенциалов
- •53. Общие критерии термодинамической устойчивости
- •54. Принцип Ле-Шателье–Брауна
- •VIII. Фазовое равновесие. Фазовые переходы
- •55. Общие соображения
- •56. Условие фазового равновесия
- •57. Фазовые переходы первого рода
- •58. Уравнение Клапейрона–Клаузиуса
- •59. Равновесие между паром и конденсированной фазой
- •60. Равновесие трех фаз
- •61. Критические явления
- •62. Метастабильные состояния
- •63. Фазовые переходы второго рода
- •64. Поверхностное натяжение
- •65. Термодинамика поверхностных явлений
- •66. Формула Лапласа
- •67. Элементарный вывод формулы Лапласа
- •68. Механическое равновесие трех сред
- •IX. Химические реакции в однородной системе. Растворы
- •69. Закон действующих масс
- •70. Формула Саха
- •71. Растворы
- •72. Полупроницаемые перегородки. Осмос
- •73. Элементы термодинамики растворов
- •74. Электролиты
59. Равновесие между паром и конденсированной фазой
При исследовании равновесия между конденсированной фазой (жидкостью, кристаллом) и паром можно считать, что молярный объем пара много больше, чем молярный объем конденсированной фазы, и последним пренебречь. Уравнение Клапейрона–Клаузиуса в этом случае примет вид
dp / dT = λ / (TVп).
Если при этом пар является достаточно разреженным, так что его можно считать идеальным газом, то Vп = RT / p и
dp / p = λ dT / (RT2). (59.1)
Зависимость λ от T может быть найдена приемом, аналогичным тому, что применялся при получении уравнения (58.1). Дифференцирование по T выражения (57.1) для λ дает
dλ / dT = ∆S + T(∆S / T)p + T(∆S / p)Tdp / dT =
= ∆S + ∆cp – T(∆V / T)p dp / dT .
С учетом уравнения Клапейрона–Клаузиуса (58.1) и того, что ∆V Vп, а пар – идеальный газ,
dλ / dT = ∆S + ∆cp – T (R / p) ∆S /Vп = ∆cp.
Таким образом, скрытая теплота перехода при некоторой температуре T равна
λ = λ0 +![]() .
(59.2)
.
(59.2)
Основным членом в выражении для λ (59.2) является первое слагаемое; второе добавляет слабую зависимость λ от T. Если λ приближенно считать постоянной, то интегрирование (59.1) приводит к
ln (p / p0) = λ / R (T0–1 – T –1) и p = A exp(– λ / (RT)).
Несложно проинтегрировать уравнение (59.1) и с учетом второго члена, когда ∆cp = const, при этом получится
ln (p / p0) = λ / R (T0–1 – T –1) + ∆cp / R ln (T/T0),
или
ln p = A – B / T + C ln T.
Это уравнение было получено Кирхгофом и широко используется для обработки экспериментальных данных.
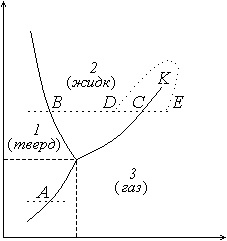
60. Равновесие трех фаз
Простейшим примером, когда в равновесии находятся одновременно три фазы химически однородного вещества, является система, состоящая из твердой фазы, жидкости и пара (для H2O это лед, вода и водяной пар). Однако большинство веществ имеет не одну, а несколько кристаллических модификаций. В связи с этим возможны такие варианты: в равновесии находятся две кристаллические и одна жидкая фазы, две кристаллические и газообразная фазы, три кристаллические фазы. Ради конкретности ниже рассматривается равновесие твердой, жидкой и газообразной фаз одного вещества.
При равновесном сосуществовании твердой фазы, жидкости и их пара должны выполняться три условия:
μ1(p, T) = μ2(p, T), μ2(p, T) = μ3(p, T), μ3(p, T) = μ1(p, T). (60.1)
Пусть первое из них выражает условие равновесия твердой и жидкой фаз, второе – жидкости и ее пара, третье – пара с твердой фазой. Каждому из этих условий на плоскости p, T отвечает кривая равновесия: первому – кривая плавления, второму – испарения и третьему – возгонки.
Одновременному выполнению трех условий (60.1) соответствует общая точка кривых равновесия, называемая тройной точкой (для нахождения ее параметров p и T имеются три уравнения: независимых уравнений два, третье есть следствие их).
Можно показать, что в тройной точке кривая возгонки идет круче кривой испарения. Действительно, из уравнения Клапейрона–Клаузиуса (58.1)
dp13 / dT = λ13 / (T(V3 – V1)) и dp23 / dT = λ23 / (T(V3 – V2)).
Молярными объемами жидкой и твердой фаз можно пренебречь по сравнению с молярным объемом газообразной фазы, т. е. знаменатели в правых частях практически одинаковы. Из первого же начала термодинамики следует, что в тройной точке
λ13 = λ12 + λ23 > λ23.
Таким образом, dp13 / dT > dp23 / dT .
p
p0 |
|
|
T0 T |
Рис. 26 |
|
Диаграмма p, T имеет вид, показанный на рис. 26. Для воды параметры тройной точки следующие: p0 = 4,58 мм рт. ст., T0 = 273,16 К. С помощью диаграммы p, T можно судить о фазовых превращениях, которые будут происходить при том или ином процессе (по этой причине плоскость p, T называют диаграммой состояний). Так, при изобарическом подводе теплоты (ему отвечает прямая, параллельная оси T) твердое вещество будет испаряться, минуя жидкую фазу, если p < p0 (точка A). Если же p > p0 (но p < pк), то твердое вещество будет вначале плавиться (точка B), а затем жидкость испаряться (точка C).