
- •2013 Фізична та колоїдна хімія
- •2.1. Електродні потенціали та механізм їх виникнення. Рівняння Нернста. Стандартні електродні потенціали. Стандартний водневий електрод. Електроди першого і другого роду. Окисно-відновні електроди.
- •2.2.Рівняння Петерса. Йонселективні електроди. Скляний електрод.
- •2.3.Електрохімічні (гальванічні) елементи та електрорушійні сили
- •2.4.Дифузійні та мембранні потенціали, їх біологічне значення. Біопотенціали.
- •2.5. Потенціометричні методи дослідження в медицині.
2013 Фізична та колоїдна хімія
Лекція № 2. Електродні потенціали та механізм їх
виникнення
2.1.Електродні потенціали та механізм їх виникнення. Рівняння Нернста. Стандартні електродні потенціали. Стандартний водневий електрод. Електроди першого і другого роду. Окисно-відновні електроди.
2.2.Рівняння Петерса. Йонселективні електроди. Скляний електрод.
2.3.Електрохімічні (гальванічні) елементи та електрорушійні сили.
2.4.Дифузійні та мембранні потенціали, їх біологічне значення. Біопотенціали.
2.5. Потенціометричні методи дослідження в медицині.
Самостійна робота : Розв’язування задач з тем «Вчення про розчини» та Електрохімія»
2.1. Електродні потенціали та механізм їх виникнення. Рівняння Нернста. Стандартні електродні потенціали. Стандартний водневий електрод. Електроди першого і другого роду. Окисно-відновні електроди.
Енергія, що вивільнюється при проходженні хімічних реакцій, може виділятись у вигляді тепла або перетворюватись в іншу форму енергії -роботу. Це може бути робота розширення, робота руху проти градієнта сили, робота збільшення поверхні, робота руху електричного заряду в електричному полі тощо. Ці види робіт можуть виконуватись системою або над системою. Якщо для одержання теплоти хімічного процесу непотрібно якихось особливих пристроїв (теплота виділяється при розчиненні цинку у соляній кислоті, горінні водню, метану, пропану та інших газів тощо), то для одержання роботи потрібен, як правило, якийсь особливий пристрій, в якому здійснюється хімічний процес і при цьому отримують роботу. Наприклад, для одержання роботи розширення таким приладом може бути поршень, який вільно рухається в ціліндрі. За таким принципом діє так званий двигун внутрішнього згорання на автомобілях.
Для перетворення енергії хімічного процесу в електричну роботу необхідно створити так званий гальванічний елемент. Вперше такий гальванічний елемент запропонували Данієль і Якобі, а теорію гальванічних елементів розробляли Фарадей, Якобі, Нернст, Оствальд та інші.
Гальванічний елемент називають хімічним, якщо джерелом електричної енергії є хімічна реакція, що відбувається в ньому. Але гальванічний елемент може працювати за рахунок вирівнювання концентрації (концентраційний гальванічний елемент), за рахунок окиснення водню киснем на електродах (паливний елемент) тощо.
Електродні потенціали
Якщо пластинку будь-якого металу, наприклад, цинку занурити у воду, то іони цинку, що утворюють кристалічну решітку металу, під дією полярних молекул води гідратуються, зв'язок їх з решіткою послаблюється, і деяка їх кількість, відриваючись від металу, перейде й воду, а на металі залишиться еквівалентна кількість електронів:
Zn = Zn2+ + 2e-
Між катіонами металу, що перейшли у воду, і негативно зарядженою пластинкою виникає електростатичне притягання, яке зумовлює зворотній процес — перехід іонів металу на пластинку; в системі встановлюється хімічна рівновага.
Іони цинку переходять із пластинки в розчин і осідають з розчину на пластинці з однаковою швидкістю. На межі між металом і розчином утворюється подвійний електричний шар і виникає стрибок потенціалу. Чим міцніше кристалічна решітка металу, тим важче іону металу перейти у розчин. Чим більша величина теплоти гідратації, тим легше іонам перейти у розчин. Отже, при зіткненні металу з водою його йони перебувають під дією двох конкуруючих сил.
Якщо рідина — вода, то для всіх металів в якісному відношенні картина буде однозначною: метал заряджається негативно, шар рідини, що прилягає до нього, позитивно. Інша картина спостерігається у випадку, якщо металеву пластинку занурити в розчин солі цього металу. Якщо метал неактивний, то буде переважати процес осадження іонів з розчину, І пластинка такого металу набуває позитивного заряду.
Отже при зануренні металевої пластинки у розчин власної солі на місці зіткнення металу з розчином виникає стрибок потенціалу, величина і знак якого залежать від хімічної природи металу та від активності його йонів у розчині.
Провідник (метал), занурений у розчин електроліту, називається електродом.
Різниця потенціалів (стрибок потенціалу), що виникає на межі поділу електрод — розчин, називається електродним потенціалом.
Величину електродного потенціалу можна розрахувати за рівнянням Нернста:
Для Т=298 К:
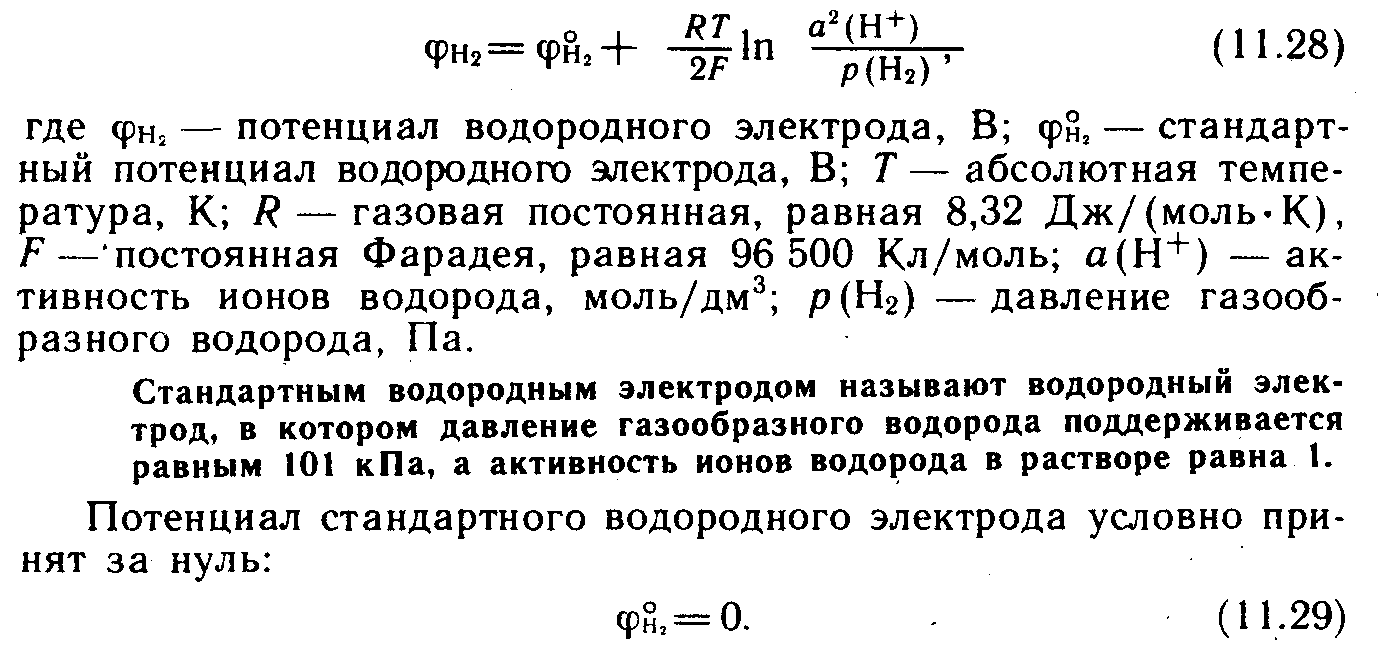
 На
тепер наука не має у своєму розпорядженні
методів, які дозволяють вимірювати
абсолютне значення електродних
потенціалів, можна виміряти тільки
різницю потенціалів. Для цього потрібно
якийсь потенціал умовно прийняти рівним
нулю. Таким потенціалом є нормальній
(стандартний) потенціал водневого
електрода. Нормальний водневий електрод
являє собою платинову пластинку, покриту
платиновою черню, занурену в розчин
кислоти, активність іонів Н+
у якому дорівнює 1 моль/л. Через розчин
пропускають ретельно очищений водень
під тиском 101325 Па (1 ат.). Поверхня платини
покривається шаром газоподібного водню.
На межі газоподібний водень — іони
гідрогену проходить реакція.
На
тепер наука не має у своєму розпорядженні
методів, які дозволяють вимірювати
абсолютне значення електродних
потенціалів, можна виміряти тільки
різницю потенціалів. Для цього потрібно
якийсь потенціал умовно прийняти рівним
нулю. Таким потенціалом є нормальній
(стандартний) потенціал водневого
електрода. Нормальний водневий електрод
являє собою платинову пластинку, покриту
платиновою черню, занурену в розчин
кислоти, активність іонів Н+
у якому дорівнює 1 моль/л. Через розчин
пропускають ретельно очищений водень
під тиском 101325 Па (1 ат.). Поверхня платини
покривається шаром газоподібного водню.
На межі газоподібний водень — іони
гідрогену проходить реакція.
У якості стандартного електрода сьогодні користуються не нормальним водневим, а іншим більш простим у виготовленні. Для виміру електродних потенціалів збирають гальванічний елемент — прилад, у якому енергія хімічної реакції безпосередньо перетворюється в електричну енергію. Він складається з двох електродів.
Електрод, потенціал якого визначають, називають Електродом визначення. Інший електрод з відомим значенням електродного потенціалу називають електродом порівняння. ЕРС гальванічного елемента дорівнює максимальній різниці електродних потенціалів. При розрахунках ЕРС від потенціалу позитивного елекроду віднімають потенціал негативного, тому що ЕРС є величиною позитивною.
Значення нормальних (стандартних) потенціалів одержують за умов що електрод визначення занурений у розчин своєї солі з активність іонів 1 моль/л, а вимірювання проходять при Т = 298 К.
Електродний потенціал — різниця електричних потенціалів між електродом та електролітом, в контакті з яким він знаходиться (найчастіше всього між металом і розчином електроліту).
Природа виникнення
При зануренні металу у розчин він «дисоціює» — його катіони починають переходити у розчин, в результаті чого на поверхні метала залишається рівний по величині, але протилежний по знаку заряд у вигляді надлишкових електронів (валентних електронів). Тобто поверхня метала стає негативно зарядженою і починає притягувати до себе позитивно заряджені іони метала, які вже перейшли в розчин і, таким чином, перешкоджає вільному пересуванню катіонів в об'ємі розчину. На границі метала з розчином виникає подвійний електричний шар, який можна уявити у вигляді плоского конденсатора, негативна обкладинка якого — це поверхня метала, а позитивна — шар розчинених іонів, який стикається з поверхнею метала. Вже після розчинення дуже невеликої кількості іонів заряд подвійного шара настільки зростає, що подальший розчин метала припиняється.
Якщо метал занурити не в воду, а в розчин своїх іонів, (наприклад, Zn в розчин ZnSO4), то картина буде виглядати інакше. Якщо концентрація розчину ZnSO4 невелика, то утворення подвійного електричного шару буде відбуватися так само, як і в воді. Якщо ж концентрація іонів в розчині висока, то спочатку буде спостерігатися осад катіонів з поверхні метала. В результаті поверхня метала зарядиться позитивно і почне притягувати негативні іони (наприклад, SO42-). Утвориться подвійний електричний шар з позитивною обкладинкою із метала і негативною — з розчинених аніонів.
Катіони будуть осідати до тих пір, доки заряд на поверхні не досягне такої величини, при якій подальший осад стане неможливим по причині відштовхування однойменних зарядів метала і його іонів.
У випадку наявності двох протилежно заряджених тіл говорять, що між ними існує різниця потенціалів. Така різниця потенціалів встановлюється у подвійному електричному шарі, на границі «метал — розчин», завдяки переходу іонів з метала в розчин та назад. Пару «метал — розчин» прийнято називати електродом, а потенціал — електродним. Різниця електричних потенціалів між металом і розчином при встановленні іонної рівноваги називається рівноважним електродним потенціалом
Величина електродного потенціалу
Величина електродного потенціалу в нерівноважному стані залежить як від природи і складу речовин-учасників електродного процесу, так і від кінетичних закономірностей електродних реакцій на границі розділу цих речовин.
Рівноважне значення стрибка потенціалів на границі розділу речовин-учасників електродного процесу визначається винятково особливостями електродної реакції і не залежить від природи електрода та адсорбції на ньому поверхнево-активних речовин.
До цього часу виміряти абсолютну величину рівноважного електродного потенціалу для якої-небудь речовини ще не вдалося.
Коли треба побудувати числову шкалу електродних потенціалів, то використовують відносний електродний потенціал, який, зазвичай, називають просто електродним потенціалом, і який представляє собою різницю потенціалів розглядаємого електрода і електрода порівняння. Роль електрода порівняння частіше за все відіграє водневий електрод, електродний потенціал якого умовно визначається приймається за нуль.
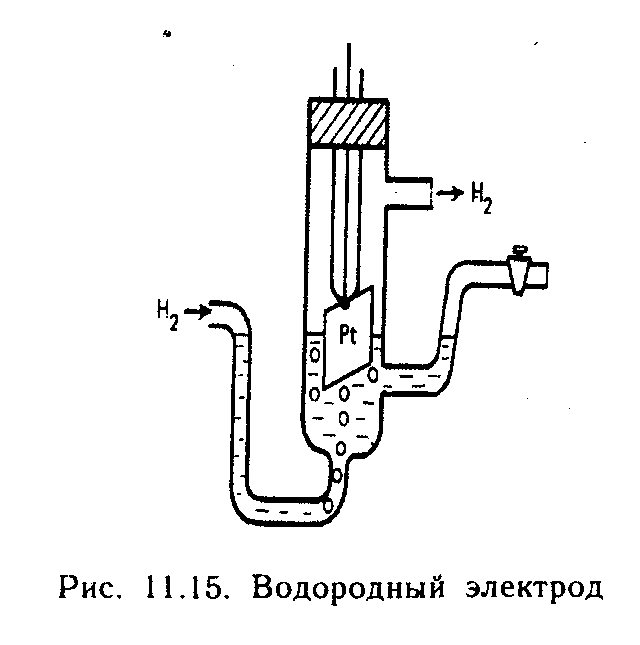
Величина електродного потенціалу залежить від активності речовин-учасників електродного процесу і вимірюється за допомогою рівняння Нернста:
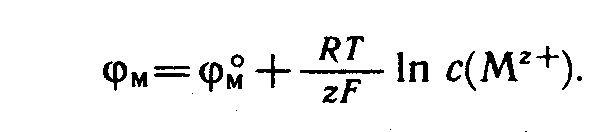
, де φ — електродний потенціал; φ0 — стандартний електродний потенціал (потенціал, який виникає на границі метала з розчином його іонів при концентрації останніх 1 моль/л); R — універсальна газова стала (R =8,31 Дж/(моль. К)); T — абсолютна температура; n — число електронів, які беруть участь в електрохімічному процесі;
F — число Фарадея (F= 96 500 Кл);
Mn + — концентрація іонів метала, моль/л.
Рівняння Нернста показує, що что електродний потенціал кожного електрода може змінюватися в дуже широкому діапазоні. Чим менша алгебраїчна величина електродного потенціалу металу, тим сильніші відновлювальні властивості має метал, і тим менші окислювальні властивості проявляє катіон цього металу.
Для окиснювально-відбудовних систем з інертним електродом, в яких всі компоненти електрохімічної реакції знаходяться в розчині, електродний потенціал (окиснювально-відбудовний потенціал) визначається активностями як окисненої (Ох), так і відбудованої (Red) форм речовини.
У випадку, коли на електроді можливе одночасне протікання більше однієї електродної реакції, використовується поняття стаціонарного електродного потенціалу. При пропусканні електричного струму вимірений електродний потенціал буд відрізнятися від рівноважного на величину поляризації.
Стандартні електродні потенціали. Стандартний водневий електрод. Електроди першого та другого родів. Окисно-відновні електроди.
Если металл погрузить в раствор его ионов концентрации 1 моль.дм-3 при 25 °С, то устанавливающийся при этих стандартных условиях потенциал называют стандар-тным электродным потенциалом (его ещё называют нормальным) рассматриваемого металла и обозначают Е°. Для каждого электрода ячейки, приведенной на рис. 13.1, погруженного в раствор его ионов концентрации 1 моль.дм-3 при 25 °С, устанавливающийся потенциал будет стандартным электродным потенциалом этого электрода, а именно : ЕоCu = + 0,34 В и ЕоZn = - 0,76 В . ( Потенциал отдельного электрода измерить нельзя, возможно лишь э.д.с. ячейки. Приводимые значения потенциалов – это э. д. с. ячеек, составленных из упомянутых электродов в стандартных условиях, и стандартного водородного электрода, потенциал которого условно принят за нуль при любой температуре и давлении Н2 1 атм. «водородная шкала».) Вольтметр же будет показывать значение э. д. с. Ячейки . Е яч. = +1.1 в, т. е. разность ЕоCu - ЕоZn .
Класифікація електродів
Класифікація електродів проводиться за хімічною природою окисненої (Ох) і відновленої (Rеd) форм речовин, які приймають участь в електродному процесі. В залежності від складу і електродної реакції їх можна поділити на електроди першого роду, другого роду, газові, окисно-відновні, мембранні та інші.
До електродів першого роду відносять системи, в яких відновленою формою є метал електрода, а окисненою формою - прості або складні комплексні іони цього металу. Схематично електрод першого роду записується таким чином:
Ме | Ме2+.
Електродні реакції в таких напівелементах відповідають реакціям окиснення, якщо в гальванічному ланцюгу метал електровід'ємний:
Ме - zе- → Меz+,
і реакціям відновлення, якщо електрод електропозитивний:
Меz+ + zе- → Ме
Прикладом електродів 1-го роду можуть служити електроди з металу, занурені у розчини своїх солей, наприклад мідь у розчині купрум (II) сульфату, срібло у розчині аргентум (І) нітрату, цинк у розчині хлориду цинка тощо. Ці електроди оборотні по відношенню до катіону, тобто їх потенціал є функцією активності катіону. Однак є невелика кількість електродів 1-го роду, оборотних по аніону, наприклад
2Te + 2e- ↔ Te22-
До електродів 1-го роду відносяться також амальгамні електроди, в яких відновленою формою служить амальгама якогось металу, а окисненою -іони того ж металу:
Сd2+ + 2е-(Нg) ↔ Сd(Нg)
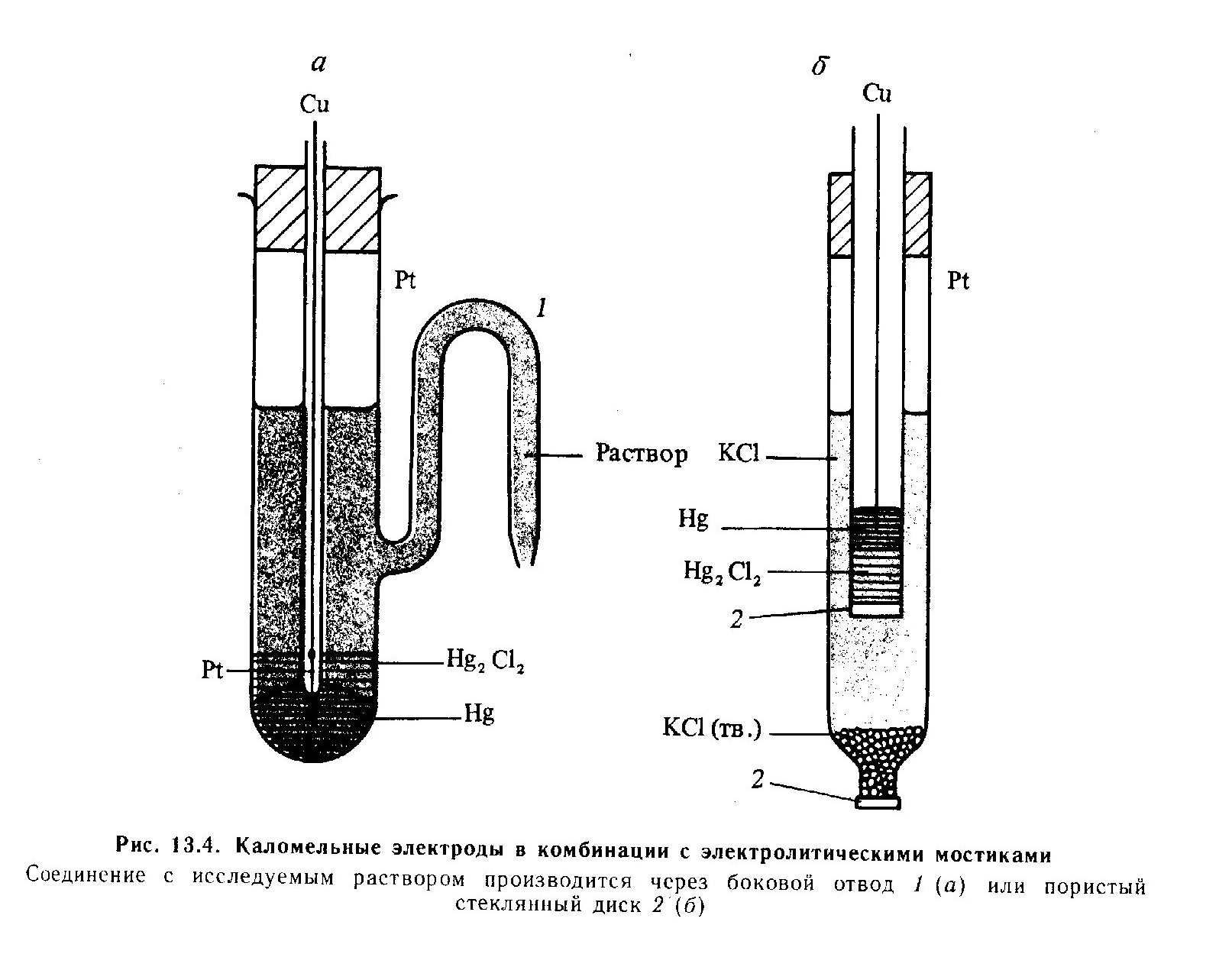 До електродів другого роду відносяться
системи, в яких метал вкритий шаром
важкорозчинної солі (або оксиду), а
розчин містить аніони тої ж солі (для
оксида - іони ОН-). Схематично
електрод другого роду зображають
так:
До електродів другого роду відносяться
системи, в яких метал вкритий шаром
важкорозчинної солі (або оксиду), а
розчин містить аніони тої ж солі (для
оксида - іони ОН-). Схематично
електрод другого роду зображають
так:
Ме, МеА | Аz-
Прикладами електродів другого роду можуть бути каломельний і хлор-срібний електроди тощо.
Окисно-відновні електроди
На будь-якому електроді проходить окисно-відновна реакція, і з цієї точки зору будь-який електрод можна назвати окисно-відновним. Однак, окисно-відновними або ред-окс-електродами називають тільки ті електроди, метал яких не бере участі в електродній реакції, а тільки переносить електрони від відновника до окислювача. Для цього використовують звичайно благородний метал. Отже, окисно- відновними, або редокс-електродами, називають напівелементи, які складаються з інертного провідника (платина, золото, графіт тощо), зануреного в розчин, де є окиснена та відновлена форми однієї і тієї ж речовини (неорганічних йонів, або органічних сполук) , наприклад,
Pt|Fe3+, Fe2+.
