
2013_______________________________
Методична розробка для організації самостійної роботи
студентів № 2.
2 години.
Дисципліна : Медична хімія (ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ )
Тема : Ферменти як біологічні каталізатори. Особливості дії ферментів.
Викладач : Рибальченко Віталій Валентинович
Курс, група : І курс , групи 11, 12, 13. Спеціальність : 5.12010102 «сестринська справа»
І. Актуальність теми : Для медицини великий інтерес представляють каталітичні процеси, що відбуваються в живих організмах при температурі тіла 309-313 /С(36-40°С). Хімічні реакції в клітинах, тканинах і різних органах живих організмів відбуваються під впливом каталізаторів біохімічних процесів, які дістали назву ферментів
ІІ. Навчальні цілі :
Знати: 1. Поняття – фермент, інгібітор.
2. Класифікацію ферментів.
3. Молекулярну будову ферменту.
Вміти: Характеризувати механізм дії ферментів та інгібіторів.
ІІІ. Матеріали доаудиторної та аудиторної самостійної роботи :
ІІІ.а. Базові знання , вміння, навички, необхідні для вивчення теми . Для вивчення теми
необхідно:
Знати |
Вміти |
З дисципліни
|
Поняття ферменти
|
Приводити приклад основних ферментів людини |
Біологія людини |
Поняття каталізатори
|
Пояснювати дію каталізаторів |
Загальна хімія |
ІІІ.б. Рекомендована література :
Основна:В.Гомонай, Фізична та колоїдна хімія. Ужгород 2006р. с. 228 – 273.
Додаткова: Ю.А. Ершов – Общая химия – Москва 2000г. с. 391-423.
- Лекція № 1
ІІІ.в. Основні етапи роботи :
1 Етап - опрацювання рекомендованої літератури .
Завдання |
Зверніть увагу |
1.Прочитати статтю «Ферменти як біологічні каталізатори. Особливості дії ферментів» . (З рекомендованої літератури або з додатка № 1.).
|
1. На накопичування енергії. 2. На особливості хімічних реакцій. 3. На номенклатуру ферментів. 4. На механізм дії ферментів |
1.Прочитати статтю «Інгібітори» . (З рекомендованої літератури або з додатка № 1.).
|
1. На визначення поняття інгібітор.
|
2 Етап - виконання завдань для самоконтролю :
Завдання |
Зверніть увагу |
1.Прочитавши статтю « Ферменти як біологічні каталізатори. Особливості дії ферментів» зробіть стислий конспект. (З рекомендованої літератури або з додатка № 1.). |
1. На накопичування енергії. 2. На особливості хімічних реакцій. 3. На номенклатуру ферментів. 4. На механізм дії ферментів |
1.Прочитавши статтю « Інгібітори» випишіть визначення поняття - інгібітор (З рекомендованої літератури або з додатка № 1.). |
1. На визначення поняття інгібітор.
|
3 Етап - закріплення знань та навичок. Після вивчення теми необхідно :
Знати |
Вміти |
|
1. Характеризувати механізм дії ферментів
|
1. Поняття інгібітор. |
1. Характеризувати механізм дії інгібітора
|
ІV. Додаткові завдання ( матеріали позааудиторної роботи ):
Пищеварительные ферменты человека. (мовою оригіналу) ( з додатка № 2).
Додатки до СПРС № 2 :
ДОДАТОК № 1.
Ферменти як біологічні каталізатори. Особливості дії ферментів.
Для медицини великий інтерес представляють каталітичні процеси, що відбуваються в живих організмах при температурі тіла 309-313 К(36-40°С). Хімічні реакції в клітинах, тканинах і різних органах живих організмів відбуваються під впливом каталізаторів біохімічних процесів, які дістали назву ферментів, а сам процес називається ферментативним каталізом. Каталітична активність ферментів у мільйони раз перевищує активність хімічних каталізаторів.
Реакції, що каталізуються ферментами, звичайно характеризуються дуже сильним прискоренням (порядку 104-105 разів) і високою специфічністю (або вибірковістю). Під специфічністю розуміють здатність ферментів прискорювати реакцію тільки між цілком визначеними речовинами, названими субстратами, і в той же час відсутність ефекту у відношенні реакцій між іншими молекулами.
Ферменти, або ензими - це білки, що відіграють роль каталізаторів у живих системах. Молекулярна маса цих білкових молекул складає 104 -107. Навіть мізерно малі кількості ферментів можуть розщеплювати величезні кількості речовин, на які вони діють. Так, 1 г кристалічного пепсину розщеплює 50 кг коагульованого яєчного білка, а І г кристалічного реніну згортає 72 т молока. Фермент перокендази, що прискорює реакції окиснення за рахунок перекису водню, виявляє свою активність при розведенні І вагової частини ферменту в 500 000 000 вагових частинах води.
Нині відомо біля 700 різноманітних ферментів. Кожний з них спеці-фічно каталізує тільки певну хімічну реакцію. Ферменти можуть бути поділені на п'ять груп (таблиця 7.1).
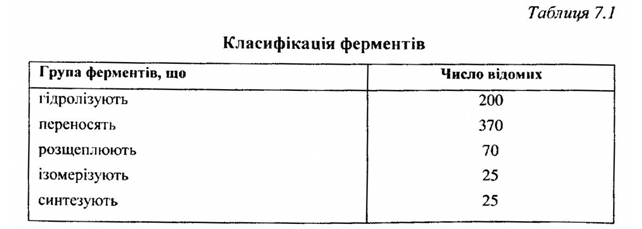
Щоб упорядкувати номенклатуру ферментів, французький вчений Дюкло запропонував називати фермент по тій речовині, яку він розщеплює, з додаванням закінчення "аза". Наприклад, фермент, що розщеплює сахарозу, називається сахароза; що розщеплює мальтозу - мальтоза і т. д. Назви ферментів можуть бути як латинськими, так і грецькими. Так, фермент, що розщеплює крохмаль, називається амілазою (від латинського атіlum -крохмаль); фермент, що розщеплює жири, - ліпазою (від грецького Lipos -жир) тощо.
На ділянці ферменту, де знаходиться активний центр, завжди є строго визначена послідовність амінокислотних залишків. Наприклад, гліцераль-дегідфосфатдегідрогенази, що виділені з дріжджів і з м'язів кролика, мають у цілому різний амінокислотний склад, але послідовність амінокислот в області активного центра протягом 18 залишків у них однакова Це явище характерне для високоспецифічних ферментів. У менш специфічних ферментів у послідовності амінокислот активного центра спостерігаються невеликі варіації.
Активність ферменту визначається не тільки хімічною будовою активного центра, але і конформацією ферменту. Інактивація ферменту може відбуватися або в результаті зміни хімічного складу активного центра, або внаслідок зміни конформації. Останнє в ряді випадків приводить до того, що активний центр стає недоступним. Можливості невеликих змін конформації в області активного центра дозволяють найкращим способом об'єднати молекули субстрату з активним центром при утворенні активного проміжного продукту.
Кращій взаємодії субстрату з ферментом сприяє також і те, що в макромолекулі ферменту є області, на яких відбувається адсорбція молекули субстрату на необхідних відстанях від активного каталітичного центру, що сприяє перебігу хімічного процесу. Адсорбційні центри забезпечують доступ до каталітичного центру тільки цілком визначеним молекулам. Внаслідок цього багато ферментів, на відміну від відомих гомогенних і гетерогенних каталізаторів, виявляють абсолютну субстратну специфічність, тобто кожний фермент здатний здійснювати оборотне або необоротне перетворення тільки одного субстрату або однієї пари (для бімолекулярних процесів) субстратів у відповідні продукти, виявляючи інертність до гомологів субстратіа Є ферменти, названі малоспецифічними, що прискорюють кілька різних типів реакцій, але і вони часто виявляються абсолютно специфічними стосовно однієї визначеної реакції.
Експериментальні дані показують, що кислотно-основні групи ферменту повинні знаходитися у визначеному стані іонізації Тому активність ферментів сильно залежить від рН середовища, в якому протікає біохімічна реакція. Для кожного ферменту існує така область значень рН у якій активність ферменту найбільша Якісно таку залежність можна пояснити зміною конформації макромолекули в результаті перерозподілу зарядів, а також зміною ступеня дисоціації кислотних груп.
З того моменту, коли Самнер у 1926 р. провів дослідження уреази (ферменту, що каталізує розкладання сечовини на аміак і вуглекислоту), стало зрозумілим, що усі ферменти є білковими молекулами. Незважаючи на те, що хіміки і біологи витратили багато зусиль в напрямку дослідження ферментативного каталізу, про деталі механізмів ферментативних реакцій відомо порівняно небагато. Звичайно, фермент містить один або кілька активних центрів, де і відбувається перетворення субстратіа Структура активного центра може бути утворена всього декількома амінокислотними залишками. Інша частина білка, можливо, необхідна для підтримки структурної цілісності цієї робочої частини. Фішер у 1890-х роках припустив, що специфічність ферментів можна уподібнити відповідності між ключем і замком. При цьому мається на увазі, що активний центр мас тверду структуру, подібно замку.
