
- •Основы гетерогенного катализа 1.1. Термодинамика, кинетика, катализ
- •1.2.Какой катализ можно назвать гетерогенным
- •1.3. Основные требования к промышленным гетерогенным катализаторам и носителям
- •1.4. Общие представления о понятии «механизм гетерогенно-каталитической реакции»
- •1.5. Экспериментальные методы исследования гетерогенных катализаторов
- •Псевдостационарные кинетические методы.
- •Стационарные кинетические методы.
- •Кинетический изотопный метод.
- •Стационарно-нестационарный изотопный кинетический метод.
- •Глава 1Метод меченых атомов.
- •Изотопный обмен.
- •1. Изотермы химической адсорбции.
- •2. Изотерма физической адсорбции.
- •3. Определение кислотности поверхности.
- •4. Измерение структуры пористости твердых тел (адсорбентов, катализаторов).
- •Удельная поверхность слоя зернистого материала.
- •1.6. Методы приготовления и производства катализаторов и носителей
- •Химия получения осажденных адсорбентов и катализаторов.
- •Получение гранул катализаторов и носителей (формование).
- •Методы получения нанесенных катализаторов.
- •2. Процессы основного органического синтеза
- •2.1. Окислительный аммонолиз пропилена в нитрил акриловой кислоты (нак)
- •2.2. Окислительное хлорирование этилена в 1,2-дихлорэтан
- •2.3. Окисление н-бутана в малеиновый ангидрид
- •2.4. Окисление этилена в оксид этилена
- •2.5. Окисление метанола на серебряных катализаторах
- •2.6. Синтезы на основе монооксида углерода и водорода
- •2.7. Каталитические процессы в нефтепереработке
2.5. Окисление метанола на серебряных катализаторах
Окисление метанола в формальдегид – один из старейших каталитических процессов. Основное применение формальдегид находит в медицине (его водный раствор - формалин) и при производстве пластмасс и смол (например, фенол- или карбамидформальдегидных).
Первоначально была реализована промышленная технология, в которой в качестве катализатора использовали серебро. В последние сорок лет развивается процесс, в котором в качестве катализатора применяют железо-молибденовые оксидные системы. Этот процесс рассматриваться не будет в связи с тем, что он, по существу, не отличается от других процессов парциального окисления углеводородов. Интерес представляет более старый процесс, поскольку это один из двух крупнотоннажных промышленных процессов парциального окисления, которые специально проводят в условиях, когда скорость химического превращения определяется скоростью внешнего массопереноса одного из участников реакции из т.н. «ядра» потока к внешней поверхности гранулы катализатора. Его реализуют в реакторах адиабатического типа в автотермическом режиме.
Другой процесс парциального окисления, который в промышленности проводится во внешнедиффузионной области – окисление аммиака в оксид азота на платиновых сетках. Во внешнедиффузионной области часто проводят также процессы полного окисления при санитарной очистке выбрасываемых газов.
Принято считать, что реакция превращения метанола в формальдегид на серебре протекает по двум механизмам – окислительному и простому дегидрированию, которые передаются стехиометрическими уравнениями (5.1) и (5.2).
СН3ОН + 0,5 О2 = НСНО + Н2О (5.1)
СН3ОН = НСНО + Н2 (5.2)
Понятно, что, кроме того, происходит окисление и метанола, и формальдегида в продукты полного окисления – оксиды углерода.
СН3ОН + 1,5 О2 = СО2 + 2 Н2О (5.3)
СН3ОН + О2 = СО + 2 Н2О (5.4)
На вход в реактор подают смесь воздуха, паров метанола и воды. Содержание метанола в этой смеси поддерживается выше верхнего предела воспламенения, т.е. выше 37% об. Мольное соотношение кислород: метанол лежит в пределах 0,28-0,33, что ниже стехиометрического с учетом соотношения скоростей (5.1) - (5.2) и селективности процесса (~ 90% мол.). Следовательно, конверсия кислорода в этом процессе практически равна 100%, а конверсия метанола меньше 100%. Если формальдегид предназначен на продажу, т.е. не используется непосредственно в том же технологическом процессе, то непрореагировавший метанол (~7%) оставляют в продукте (т.н. «метанольный формальдегид»), поскольку метанол препятствует полимеризации формальдегида при транспортировке.
Продукт окисления метанола на железо-молибденовых катализаторах называется «безметанольным», т.к. этот процесс ведется в стехиометрическом избытке кислорода и конверсия метанола в нем близка к полной.
Рассмотрим основные особенности протекания процесса во внешнедиффузионной области. Вначале проанализируем кинетику реакции в этой области. В стационарных условиях скорость химической реакции равна скорости массоподвода к внешней поверхности гранулы катализатора (5.5).
![]() (5.5)
(5.5)
Здесь δ – толщина пограничного слоя, см, Dv коэффициент объемной диффузии, см2/с, Sвн – удельная поверхность слоя катализатора, т.е. его наружная поверхность, см-1 , C и Cs – концентрации реагирующего вещества в «ядре» потока и у поверхности гранулы катализатора, k – константа скорости первого порядка, 1/с. Из (5.5) следует (5.6).
![]() (5.6)
(5.6)
и для скорости реакции r
![]() (5.7)
(5.7)
Если
![]() ,
т.е. химическая реакция много быстрее,
чем массоподвод, то из (5.6) и (5.7) следует
C
>>Cs,
т.е. концентрация реагирующего вещества
(в рассматриваемом случае - кислорода,
поскольку он подается на реакцию в
стехиометрическом недостатке) у
поверхности гранулы близка к нулю, и
скорость его расходования (5.8).
,
т.е. химическая реакция много быстрее,
чем массоподвод, то из (5.6) и (5.7) следует
C
>>Cs,
т.е. концентрация реагирующего вещества
(в рассматриваемом случае - кислорода,
поскольку он подается на реакцию в
стехиометрическом недостатке) у
поверхности гранулы близка к нулю, и
скорость его расходования (5.8).
![]() (5.8)
(5.8)
В (5.8) - x – степень превращения кислорода, τ = l/ω – условное время контакта, l – координата вдоль длины слоя катализатора, ω – линейная скорость, β = Dv/δ – коэффициент массоотдачи, см/с, для шаров и равновеликих цилиндров Sвн = 6/d.
Из теории подобия известны несколько эмпирических зависимостей, связывающих критерии Нуссельта Nu (или Шервуда Sh), Рейнольдса Re и Прандтля Pr (или Шмидта Sc), например
Nu = βd/Dv = aRe0,66Pr0,33 = a(ωd/ν) 0,66 (ν/d)0,33 (5.9)
(a – постоянная, найденная из опытов, ν – кинематическая вязкость, d – линейный размер, для нашей задачи – размер гранулы катализатора).
Интегрирование
(5.8) (с учетом того, что для газов ν
≈ Dv)
по времени контакта (при длине слоя
катализатора h)
дает (5.9). ![]() (5.10)
(5.10)
Из (5.10) следует, что во внешнедиффузионной области при увеличении размера гранул катализатора и линейной скорости степень превращения уменьшается.
Теперь рассмотрим преимущества проведения процесса окисления метанола во внешнедиффузионном режиме. Одно из этих преимуществ очевидно и носит общий характер. Поскольку скорость химической реакции в этом режиме много выше, чем скорость массоподвода, то понятно, что это максимально возможная скорость процесса – для того, чтобы вещество прореагировало, оно должно достичь, по крайней мере, наружной поверхности гранулы катализатора. Действительно, процессы в области внешней диффузии протекают при объемных нагрузках, лежащих в пределах 36000 – 100000 л(газа)/л(кат) час, т.е. при условных временах контакта 0,1 – 0,036 с (в кинетической или внутридиффузионной области условное время контакта составляет величины порядка секунд). Иными словами, количество катализатора, загружаемого в реактор, мало. Например, в реактор окисления метанола на серебре диаметром около метра и производительностью 60 тыс. тонн в год загружается около 200 литров катализатора, что соответствует толщине слоя 6-7 см.
Другое преимущество внешнедиффузионного режима, относящееся конкретно к процессу окисления метанола на серебре, который, как отмечалось выше, проводится в адиабатическом реакторе, требует более детального обсуждения. Напомним, что из кинетической теории газов следует не только ν ≈ Dv (что было использовано выше), но и примерное равенство им и коэффициента температуропроводности λ. Физически это связано с тем, что и массоперенос, и теплоперенос, и вязкостные свойства определяются движением атомов или молекул газов. Поэтому, если во внешнедиффузионном режиме медленным является подвод массы к поверхности гранулы, то и отвод тепла в обратном направлении является медленным процессом. Тогда, температура на поверхности гранулы оказывается равной сумме температур газа в «ядре» потока и адиабатического разогрева для состава этого газа. Температура адиабатического разогрева зависит от теплоемкости продуктов реакции, но главным образом определяется начальной и конечной концентрациями кислорода. Для состава смеси на входе в реактор при полной конверсии кислорода – это ~ 6000 С. Тогда, если температура исходной реакционной смеси на входе в реактор 1000 С, то на выходе из реактора температура составит ~ 7000 С.
Мысленно разобьем слой катализатора на несколько, например, десять частей так, чтобы на конце первой части степень превращения кислорода была 10%, второй – 20% и т.д. до десятой, на выходе из реактора, где весь кислород прореагировал. На входе в реактор, на первом отрезке, температура у поверхности гранулы складывается из двух температур – газа в «ядре» потока и адиабатического разогрева при полном превращении кислорода (поскольку в «ядре» потока концентрация кислорода – начальная, а у поверхности гранулы - нулевая), в стационарных условиях она равна 7000 С..
На практике при пуске реактора гранулы в лобовом слое катализатора можно разогреть с помощью электрической «зажигалки».
Рассмотрим бесконечно малый слой катализатора на втором отрезке, где на входе в него степень превращения кислорода уже 10%. Температура газа в этом сечении соответствует адиабатическому разогреву газа в «ядре» потока при этой степени превращения, т.е. 1000 С +600 С = 1600 С, а адиабатический разогрев у поверхности гранулы - 90% от полного, т.е. 5400 С. Отсюда температура гранулы равна 7000 С. Для бесконечно малого слоя катализатора в следующем сечении температура газа в «ядре» потока равна 2200 С, адиабатический разогрев у поверхности гранулы - 4800 С, а температура гранулы также равна 7000 С и т.д. (см. рис. 5.1.а).
Такая же картина следует из анализа теплоотвода от гранулы к «ядру» потока. В стационарных условиях необходимо отвести все выделяющееся тепло реакции (Qр), которое пропорционально количеству подведенного к грануле кислорода, т.е. пропорционально концентрации кислорода в «ядре» потока. Теплоотвод же пропорционален разности температур Tядро потока – Tгранулы, а эта разность равна адиабатическому разогреву при полном превращении того количества кислорода, которое подводится к грануле катализатора.
Теперь рассмотрим изменение концентраций исходных веществ и продуктов реакции по длине слоя катализатора (рис. 5.1.б и с). При этом учтём, что целевой продукт реакции – формальдегид – легко, гомогенно в газовой фазе окисляется кислородом при температурах 3500С ÷3700С. Иными словами, для сохранения образовавшегося формальдегида необходимо обеспечить температуру не выше 3500 С и (или) низкую, близкую к нулю, концентрацию кислорода.
Эти требования удовлетворяются проведением процесса в области внешней диффузии при стехиометрическом недостатке кислорода. Действительно, вблизи поверхности гранулы, где температура ~ 7000С, концентрация кислорода близка к нулю. В то же время в «ядре» потока в начале слоя, где высокая концентрация кислорода, во-первых, низкая температура и, во-вторых, сравнительно низкая концентрация формальдегида, а в конце слоя, где высокая температура и высокая концентрация формальдегида, наоборот, концентрация кислорода низкая. Кроме того, гомогенному (и цепному) окислению препятствует сам катализатор, играющий роль стенки, обрывающей цепи. Тем не менее, на выходе из слоя катализатора ставят закалочный холодильник, предназначенный для снижения температуры ниже 3000 С.
 а
а
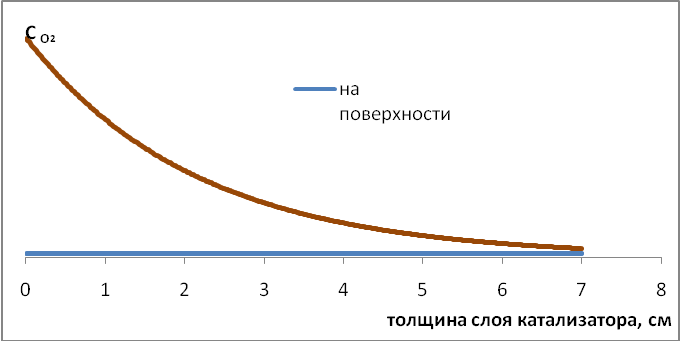 б
б
 в
в

 h
h
5.1. Зависимости концентраций участников реакции и температур в «ядре потока» и на поверхности катализатора от высоты слоя
