
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
4.9. Електронний парамагнітний резонанс (епр)
Метод ЕПР за фізичними принципами подібний до методу ЯМР і широко застосовується в біофізичних експериментах. ЕПР базується на наявності в неспареного електрона магнітного моменту. Речовини, в яких присутні неспарені електрони, мають парамагнітні властивості. Парамагнетиками є вільні радикали, які утворюються в багатьох біохімічних реакціях, при фотохімічному окисненні хлорофілу у фотосинтетичних системах чи за шкідливої дії іонізуючої радіації на біологічні об’єкти. Парамагнетизм виявляють іони металів перехідної групи Fe, Co, Ni, Cu, Mn. Великого поширення набув метод спінових міток, коли до досліджуваного об’єкта (біомакромолекули чи мембрани) додають стабільні парамагнітні речовини й через ЕПР-спектри вивчають структурно-динамічні характеристики об’єкта.
Обертання електрона навколо власної осі спричиняє спіновий магнітний момент
e = g e S, (4.50)
де
S
– спін електрона (S
= 1/2); е
– магнетон Бора,
![]() е
і m
– заряд і маса електрона; h
– стала Планка,
е
і m
– заряд і маса електрона; h
– стала Планка,
![]() ;
g
– g-фактор
або фактор Ланде (для вільного електрона
g
= 2,0023). Якщо парамагнітна речовина
розміщується в зовнішньому магнітному
полі Н,
енергія взаємодії Ее
парамагнітної молекули із цим полем
становитиме:
;
g
– g-фактор
або фактор Ланде (для вільного електрона
g
= 2,0023). Якщо парамагнітна речовина
розміщується в зовнішньому магнітному
полі Н,
енергія взаємодії Ее
парамагнітної молекули із цим полем
становитиме:
Ee = - еH = - g e S H. (4.51)
Відповідно магнітному квантовому числу MS = -1/2 і MS = +1/2, у зовнішньому магнітному полі можливі тільки дві орієнтації спіна: за полем з енергією Е1 = ½ g e H і проти поля з енергією E2 = - ½ g e H. Різниця між двома енергетичними рівнями Ee = E1 – E2 = g e H. Якщо до системи підвести високочастотне електромагнітне випромінювання частотою 0, яке є перпендикулярним магнітному полю Н, то можна досягти електронного парамагнітного резонансу, якщо виконується умова
h0 = Ee = g e H. (4.52)
Завдяки енергії квантів h0 електрони будуть переходити між двома енергетичними рівнями Е1 і Е2.
Порівняємо
величину енергетичного розщеплення
Ее
для
неспареного електрона (метод ЕПР) і Ея
для ядер (протонів) (метод ЯМР) та оцінимо,
на яких частотах
і за яких величин Н
виявляються
резонансні ефекти. У методі ЕПР частотний
інтервал лежить в інтервалі від 1 до 40
ГГц. Нехай резонанс виконується
на частоті 0
= 10 ГГц = 1010
Гц. Тоді Ее
= h0
=
6,63
10-34
1010
= 6,63
10-24
Дж. Як бачимо, це дуже мала енергія між
двома енергетичними рівнями неспареного
електрона. Оцінимо величину магнітного
поля Н
за резонансу на частоті 0
= 10 ГГц:
![]() .
Отже, в методі ЕПР використовуються
магнітні поля від 0,1 до 1 Тл. У методі ЯМР
резонансні частоти лежать в межах від
100 до 500 МГц. Тоді Ея
= h0
=
6,63
10-343108
= 1,989
10-25
Дж. Енергія Ее
більша, ніж на порядок, за енергію Ея
між енергетичними рівнями протонів.
Величина магнітного поля в ЯМР становить:
.
Отже, в методі ЕПР використовуються
магнітні поля від 0,1 до 1 Тл. У методі ЯМР
резонансні частоти лежать в межах від
100 до 500 МГц. Тоді Ея
= h0
=
6,63
10-343108
= 1,989
10-25
Дж. Енергія Ее
більша, ніж на порядок, за енергію Ея
між енергетичними рівнями протонів.
Величина магнітного поля в ЯМР становить:
![]() У методі ЯМР величина магнітного поля
змінюється в межах від 1 до 10 Тл. За
температури 20оС
(теплова енергія WT
=
k0T
4
10-21
Дж) енергія магнітних резонансів, ЯМР
і ЕПР є значно меншою за теплову: Ея
<
Ее
<<
WT.
У методі ЯМР величина магнітного поля
змінюється в межах від 1 до 10 Тл. За
температури 20оС
(теплова енергія WT
=
k0T
4
10-21
Дж) енергія магнітних резонансів, ЯМР
і ЕПР є значно меншою за теплову: Ея
<
Ее
<<
WT.
Принцип
роботи ЕПР-спектрометрів близький до
роботи ЯМР-спектрометрів. Значного
поширення набули ЕПР-спектрометри, які
працюють на
за
0
= 3 см (0
~
10 ГГц), – спектрометри Х-діапазону.
Застосовуються також ЕПР-спектрометри
Q-діапазону (0
= 8 мм; 0
37,5 ГГц). У спектрометрах ЕПР сигнал
реєструється як перша похідна
![]() від поглиненої потужності Р
електромагнітного поля (рис. 4. 25).
від поглиненої потужності Р
електромагнітного поля (рис. 4. 25).
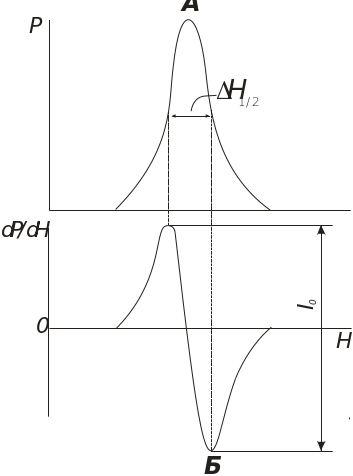
Рис. 4.25. Спектр ЕПР:
А – смуга поглиненої потужності Р електромагнітного випромінювання; Б – перша похідна dP/dH H1/2 – напівширина смуги; І0 – інтенсивність спектра ЕПР
Основними параметрами, які визначаються в ЕПР-спектрометрії, є інтенсивність І0 сигналу ЕПР, величина g-фактора, надтонка структура спектра (НТС). Як і в ЯМР, у методі ЕПР визначається час спін-коміркової релаксації Т1 і час спін-спінової релаксації Т2. Т1 і Т2 зумовлюють ширину ліній у спектрі ЕПР. Інтенсивність І0 пропорційно пов’язана з концентрацією парамагнітних частинок. НТС ЕПР зумовлено взаємодією магнітних моментів е неспарених електронів з магнітними моментами ядер я. Взаємодія неспареного електрона з ядром, яке має спін І, приводить до розщеплення кожної резонансної лінії в ЕПР-спектрі на 2І + 1 лінію. Якщо неспарений електрон присутній у полі протона з І = 1/2, то НТС має вигляд двох ліній, у неспареного електрона в атомі N (I = 1) НТС матиме вигляд трьох ліній.
Метод ЕПР давно застосовується для дослідження білків, в яких містяться парамагнітні іони металів (Fe, Cu). Це залізовмісні білки (міоглобін, гемоглобін, цитохроми), мідьвмісні білки (цитохроми). Метою багатьох досліджень є визначення різниці між здоровою й паталогічною тканиною чи кров’ю. В основі аналізу захворювання лежить інтенсивність сигналу І0, яка корелює з концентрацією парамагнітних іонів металів. Наприклад, концентрація Cu2+ (g 2,05) зростає у плазмі крові під час найгострішого захворювання, тоді як концентрація Fe3+ (g 4,3 в трансферині і g 6 в гем-групі) зменшується.
Метод спінових міток. Cтабільні вільні радикали, які ковалентно зв’язуються з білками чи ліпідними молекулами мембрани, називаються спіновими мітками. Спектр ЕПР спінової мітки чутливий до властивостей свого мікрооточення. При зв’язуванні спінової мітки необхідно впевнитися в тому, що властивості досліджуваної біомакромолекули суттєво не змінюються. Для цього вимірюють активність ферменту до приєднання й після приєднання мітки. Якщо ці контрольні вимірювання показали, що конформація чи активність ферменту не змінилися, це свідчить про достовірність інформації про стан системи, досліджуваною за допомогою спінової мітки.
Найчастіше застосовуються спінові мітки, які включають нітроксильний радикал з атомною групою, що має неспарений електрон на 2р -орбіталі атома N (рис. 4.26, А). Стабільність нітроксильних радикалів зумовлено екрануванням NO-групи чотирма СН3-групами. Такі речовини, як аскорбінова кислота, хінони відновлюють нітроксильний радикал, і він втрачає парамагнітні властивості.
Взаємодія неспареного електрона з ядром атома N визначає НТС, яка складається з трьох ліній (рис. 4.26, Г). Оскільки 2р -орбіталь не має сферичної симетрії, це створює анізотропію НТС, яка характерна для зорієнтованих у кристалевих матрицях нітроксильних радикалів. Як видно з рисунка, найбільш надтонке розщеплення спостерігається для z-компоненти, для якої 2р -орбіталь неспареного електрона і магнітне поле Н зорінтовані вздовж осі z. Коли магнітне поле Н орієнтується паралельно ху-площині, х- і у-компоненти надтонкого розщеплення мають мінімальні значення.
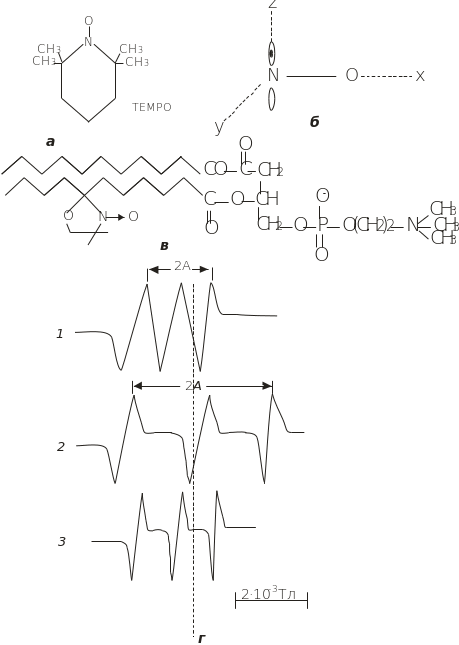
Рис. 4.26. Метод спінових міток:
а – структурна формула спінової мітки ТЕМРО; б – молекулярні осі парамагнітного фрагмента спінової мітки; в – спін-мічений фосфоліпід; г – спектри ЕПР спінової мітки у кристалічному стані: магнітне поле орієнтоване вздовж осі х чи y (1) та вздовж осі z (2); в розчині (3)
Експериментально вимірюється величина надтонкого розщеплення, 2Аxx, 2Аyy, 2Аzz – відстань (Тл) між крайніми піками у спектрі ЕПР. Анізотропні ефекти виявляються й для g-фактора неспареного електрона. У модельних дослідженнях для ди-трет-нітроксильного радикала (рис. 4.26, а) отримано такі анізотропні параметри: для величини надтонкого розщеплення Ахх = 0,71 мТл, Ауу = 0,52 мТл, Аzz = 3,1 мТл; для g-фактора gxx = 2,0089, gyy = 2,0061, gzz = 2,0027. Якщо нітроксильний радикал перебуває не у кристаличному, а в рідкому середовищі, то швидкий ізотропний рух радикала приводить до усереднення анізотропії й середня величина надтонкого розщеплення становить А0 = 1/3 (Аxx + Аyy + Аzz). Для ди-трет-нітроксильного радикала А0 = 1,5 мТл і g0 = 2,0059.
Метод спінових міток має велику чутливість й надає інформацію про молекулярну структуру й рухомість його чиїх? елементів. Часові інтервали молекулярної рухомості спінової мітки (10-6–10-8с) є значно коротшими, ніж в ЯМР-спектроскопії (10-3–10-4 с), і довшими, ніж у флуоресцентній спектроскопії (10-8–10-10 с).
Анізотропія надтонкого розщеплення А і g-фактора сильно залежать від в’язкості середовища, в якому перебуває спінова мітка. У разі великої рухомості мітки (в’язкість низька) спектральні лінії є дуже вузькими, а коли відбувається повна іммобілізація мітки (в’язкість висока) спектральні лінії значно розширюються. Надтонке розщеплення залежить від локальної діелектричної константи й помітно зростає зі збільшенням полярності середовища. Нітроксильні мітки в напівполярному середовищі мають меншу величину надтонкого розщеплення (1,4 мТл), ніж у водній фазі, де ця величина становить 1,5 мТл.
За допомогою методу спінових міток досліджуються конформаційні переходи в білках, а також динаміка білкової структури в тій ділянці, де приєднана спінова мітка. Широкого застосування набули спінові мітки при дослідженні динаміки структури біологічних мембран. Спінова мітка ковалентно приєднується до гідрофобного хвоста ліпідної молекули, й експериментально вимірюється параметр упорядкованості S:
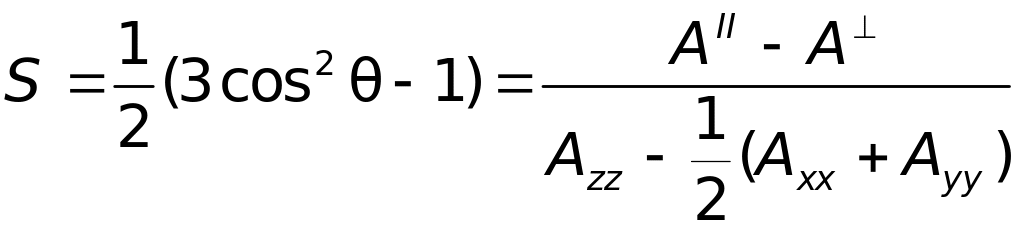 , (4.53)
, (4.53)
де
![]() –
кут між z-віссю
2р
-орбіталі
неспареного електрона й перпендикуляром
до мембрани; АII
і А
– величина надтонкого розщеплення у
спектр ЕПР, коли магнітне поле Н
є
паралельним
і перпендикулярним до орієнтації
ліпідних молекул у мембрані, відповідно;
Ахх,
Аyy
i Azz
– величини надтонкого розщеплення для
даної спінової мітки, які отримані в
модельних дослідженнях, коли спінова
мітка жорстко зорієнтована у кристалічному
матриксі. Коли мембранні ліпіди
перебувають у кристалічному стані
(L-фаза)
і їхні рухи є мінімальними, параметр
упорядкованості S
= 1, а
=
0о.
У разі значної рухомості ліпідів
(L-фаза)
S0,
а кути
54о.
Методом спінових міток досліджується
рухомість у мембрані білків і ліпідів
(латеральна дифузія), а також переходи
ліпідів між мембранними шарами (фліп-флоп
перескоки переходи).
–
кут між z-віссю
2р
-орбіталі
неспареного електрона й перпендикуляром
до мембрани; АII
і А
– величина надтонкого розщеплення у
спектр ЕПР, коли магнітне поле Н
є
паралельним
і перпендикулярним до орієнтації
ліпідних молекул у мембрані, відповідно;
Ахх,
Аyy
i Azz
– величини надтонкого розщеплення для
даної спінової мітки, які отримані в
модельних дослідженнях, коли спінова
мітка жорстко зорієнтована у кристалічному
матриксі. Коли мембранні ліпіди
перебувають у кристалічному стані
(L-фаза)
і їхні рухи є мінімальними, параметр
упорядкованості S
= 1, а
=
0о.
У разі значної рухомості ліпідів
(L-фаза)
S0,
а кути
54о.
Методом спінових міток досліджується
рухомість у мембрані білків і ліпідів
(латеральна дифузія), а також переходи
ліпідів між мембранними шарами (фліп-флоп
перескоки переходи).
