
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
4.8. Ядерний магнітний резонанс (ямр)
Метод ЯМР широко використовується для дослідження конформаційних перебудов і динаміки білкової структури. Усі ядра з непарним масовим числом мають механічний момент спін І. Такі ядра, як 1H, 13C, 19F, 31P, мають І = 1/2. В ядр з парними масовими числами І = 0 (12С, 16О) або І = 1 (2H, 14N).
Розглянемо природу ЯМР на прикладі протона, найбільш простого ядра зі спіном І =1/2. Атоми H є найбільш розповсюдженими в біологічних системах, і тому протонний ЯМР (ПМР) широко використовується для дослідження білків, нуклеїнових кислот і мембран. Добре також розроблений 31Р – ЯМР.
Обертання протона спричиняє появу ядерного магнітного моменту
я = gяяI, (4.37)
де gя – ядерний g–фактор; я – ядерний магнетон (я = 5,05 10-27 Дж Тл-1). я виражається через заряд е і масу Мя протона таким чином:
![]() (4.38)
(4.38)
Якщо підставити (4.38) в (4.37), то магнітний момент запишеться так
![]() , (4.39)
, (4.39)
де
gя
e/2Mя
=
![]() – гіромагнітне
відношення.
– гіромагнітне
відношення.
Враховуючи наявність у протона магнітного моменту я, схематично протони можна представляти як елементарні магніти. Якщо зовнішнє магнітне поле відсутнє, тоді протони-магніти хаотично орієнтуються. За накладання магнітного поля Н0 воно взаємодіє з протонами з енергією
E = -я Н0 = -gяяIH0 (4.40)
і
орієнтує їх у зовнішньому магнітному
полі. Для протона І
може
бути + ½ чи – ½ . Тоді в полі Н0
можливі дві орієнтації протона: по полю
з енергією
![]() і проти поля з
і проти поля з
![]() (рис. 4.21).
(рис. 4.21).
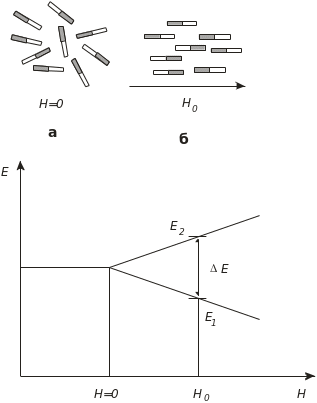
Рис. 4.21. Діаграма рівнів й орієнтація ядер у зовнішньому магнітному полі:
а – хаотичний розподіл ядер у відсутності поля, H = 0; б – орієнтація ядер при накладанні поля Н0; Е – різниця енергетичних рівнів
Різниця енергії між рівнями
E = E2 – E1 = gяяН0. (4.41)
Кількість протонів на рівнях Е2 і Е1 за температури Т співвідноситься за больцманівським розподілом таким чином
![]() . (4.42)
. (4.42)
У
магнітному полі Н0
=
1 Тл (1 Тл = 104
Гс)
за Т
=
300 К співвідношення протонів становить
![]() ~1,000007.
Це вказує на те, що за кімнатної температури
енергія взаємодії протона з магнітним
полем є дуже малою порівняно з тепловою
енергією протонів k0Т
і тільки невелика кількість ядер
орієнтується по
полю
– усього 0, 00007 %. Але цей невеликий
надлишок зорієнтованих ядер створює
намагніченість речовини й через це
відбуватиметься поглинання електромагнітної
енергії.
~1,000007.
Це вказує на те, що за кімнатної температури
енергія взаємодії протона з магнітним
полем є дуже малою порівняно з тепловою
енергією протонів k0Т
і тільки невелика кількість ядер
орієнтується по
полю
– усього 0, 00007 %. Але цей невеликий
надлишок зорієнтованих ядер створює
намагніченість речовини й через це
відбуватиметься поглинання електромагнітної
енергії.
Для виявлення Ея необхідно накласти змінне електромагнітне поле із частотою . Енергії цього поля може поглинатися за умови, що магнітний вектор змінного електромагнітного поля перпендикулярний напрямку постійного магнітного поля Н0 й частота поля 0 задовольняє умові ЯМР:
h0 = gяяH0. (4.43)
Поглинена енергія витрачається на зміну однієї орієнтації протонів на іншу. На рис.4.22 зображено спрощену блок-схему ЯМР-спектрометра.

Рис. 4.22. Блок-схема ЯМР-спектрометра:
1 – зразок; 2 – електромагніт зовнішнього поля Н; 3 – джерело напруги електромагніта; 4 – генератор електромагнітного поля; 5 – спіраль для передавання електромагнітної енергії частотою ; 6 – приймальна спіраль; 7– система реєстрації сигналів ЯМР
У ньому використовується постійна частота електромагнітного поля 0, а для отримання резонансу змінюється величина зовнішнього магнітного поля Н0. Розглянемо, які параметри вимірюються за допомогою ЯМР-спектроскопії.
Спін-коміркова
й спін-спінова релаксація.
У
відсутності зовнішнього магнітного
поля ядра з магнітним моментом
мають
хаотичну орієнтацію, й у речовині
відсутня намагніченість. Якщо вмикається
зовнішнє магнітне поле Н0,
спрямоване вздовж осі z,
ядра орієнтуються вздовж поля й будуть
прецесувати навколо осі z
з ларморовою частотою 0
(0
=
2![]() 0).
Як результат орієнтації магнітних
моментів ядер з’явиться сумарна
поздовжня намагніченість Мz,
яка являє собою суму проекцій на вісь
z
магнітних
моментів окремих ядер.
0).
Як результат орієнтації магнітних
моментів ядер з’явиться сумарна
поздовжня намагніченість Мz,
яка являє собою суму проекцій на вісь
z
магнітних
моментів окремих ядер.
В xy-площині намагніченість відсутня, оскільки окремі ядерні моменти прецесують не у фазі та їхні проекції компенсують одна одну. Якщо накласти електромагнітне поле, в якому вектор магнітної складової Нxy лежить в xy-площині й обертається із частотою, яка дорівнює ларморовій частоті 0, то відбудеться перехід від попередньої прецесії (вздовж осі z) до нової прецесії, зокрема в напрямку y. Поки діятиме електромагнітне поле, повздовжня намагніченість Мz буде відсутня, натомість з’явиться поперечна намагніченість Мy. При вимиканні електромагнітного поля Нxy одночасно спостерігаються два релаксаційні процеси.
1. Поздовжня намагніченість Мz відновлюється в часі до свого рівноважного значення М0, оскільки збуджені спіни віддають свою енергію оточенню (це оточення називається коміркою):
![]() . (4.44)
. (4.44)
де Т1 – постійна часу цього процесу або час поздовжньої спін-коміркової релаксації.
2. Водночас когерентність спiнів, які прецесували у фазі в напрямку y, втрачається через спін-спінові взаємодії й поперечна намагніченість зникає в часі:
![]() . (4.45)
. (4.45)
де Т2 – постійна часу цього процесу або час поперечної спін-спінової релаксації. На відміну від поздовжньої релаксації поперечна релаксація проходить без втрати енергії спінової системи.
Релаксація поздовжньої складової Мz до рівноваги відбувається під впливом флуктуюючих магнітних полів у самій комірці, що буде значно змінювати величину Т1. У твердих тілах, де рух молекул значно обмежений, Т1 достатньо велике, досягаючи годин. У рідинах і газах рухи молекул інтенсивні й спектр флуктуюючих полів широкий (багато з них близькі до ларморової частоти 0), що зменшує Т1 до секунд. Наявність парамагнітних речовин у комірці також значно прискорює процес поздовжньої релаксації. Наприклад, для бензолу в дегазованому розчині сірководню Т1 = 60 с. За наявності кисню в цьому розчині, який є парамагнетиком, Т1 = 2,7 с.
Напівширина ліній 1/2 у спектрах ЯМР залежить від Т1 і Т2:
![]() . (4.46)
. (4.46)
Але в багатьох випадках 2Н2хуТ1Т2 <<1, і тому
![]() чи
чи
![]() . (4.47)
. (4.47)
Отже, спін-спінова релаксація зумовлює ширину ліній ЯМР і за виразом (4.47) із напівширини лінії ЯМР легко знаходиться Т2.
Хімічний зсув. Експериментальні значення резонансних ліній ЯМР для ядер в атомах і молекулах дещо відрізняються від теоретичної величини gяяH0, яку отримують для вільного ядра. Це зумовлено ефектом екранування, який спричиняється через вплив локального магнітного поля, яке створюється всередині атома електронними струмами, що індукуються зовнішнім магнітним полем. Ці електронні струми утворюють допоміжне поле на ядрах, яке за величиною пропорційне, а за напрямком протилежне полю Н0. Тому ефективне поле Не, яке діє на ядро (протон), буде менше, ніж прикладене поле Н0:
He
=
H0
- H0
i
![]() , (4.48)
, (4.48)
де – константа екранування. Вона є дуже малою, і її величина становить 10-6. Цінність методу ЯМР полягає в тому, що резонансні лінії значно відрізняються залежно від того, в яких атомних групах перебуває протон. Зміщення резонансної частоти, яке зумовлене хімічним оточенням протону, називається хімічним зсувом. Для вимірювання хімічних зсувів у більшості випадків у кювету з досліджуваною речовиною додається еталон – тетраметилсилан (ТМС), (CH3)4Si. Ця речовина має 12 еквівалентних протонів, які дають одну резонансну лінію, яка розташована на достатньо далекій відстані від інших резонансних ліній. Шкала хімічних зсувів визначається як
![]() , (4.49)
, (4.49)
де Нзр і Нет – резонансні магнітні поля (магнітна індукція в теслах) для зразка й еталона; зр і ет – резонансні частоти для зразка й еталона. Значення виражаються в мільйонних частках (м.ч.) (англ. parts per million – ppm). У шкалі , де за еталон слугує тетраметилсилан з = 0, всі резонансні смуги досліджуваних речовин мають > 0. Коли магнітне поле становить 5 Тл, лінії резонансного поглинання більшості протонів лежать у межах від 0 до 2500 Гц близько від основної частоти 0 = 220 МГц. У цьому випадку резонансні значення розміщуватимуться в інтервалі від 0 до 10 м.ч. на шкалі .
Чутливість і роздільну здатність методу ЯМР демонструє спектр ПМР етанола (рис. 4. 23).
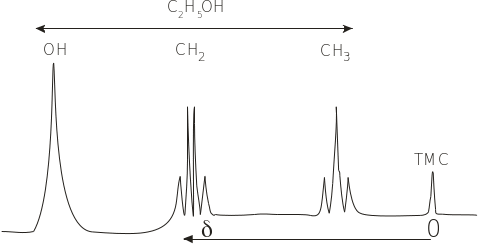
Рис. 4.23. Спектр ПМР етилового спирту: – хімічний зсув. Резонансна смуга еталона ТМС з = 0
Як видно з рисунка, є три групи ліній з різними , за якими в молекулі етанолу чітко ідентифікуються ОН-, СН2- і СН3-групи. У розділених спектрах окремих груп часто спостерігається допоміжне розщеплення ліній за рахунок впливу сусідніх ядер на дане ядро. Це спін-спінове розщеплення ліній, що характеризується константою спін-спінової взаємодії J як відстань між сусідніми лініями. Метильна група СН3 розщеплюється на три компоненти, а метиленова група СН2 – на чотири.
За шириною ліній спектра ЯМР оцінюється відносна рухомість ядер. Якщо ядро рухається дуже швидко, що характерно для малих молекул, лінії є дуже вузькими. Якщо ядро рухається повільно, як у фіксованій третинній структурі біомакромолекули, лінії значно розширюються. Ширину ліній використовують для оцінки рухомості функціональної групи або мономерного залишку в полімері.
Дослідження структури білків методом ПМР. Аналіз спектрів ПМР білків утруднюється через наявність великої кількості атомів водню. Накладання резонансних ліній створює значне розширення смуг у спектрах ПМР білків. Аналіз проводиться в окремих ділянках спектра, де присутні резонансні лінії амінокислотних залишків: для аліфатичних груп амінокислот лежить у межах від 1 до 4,5 м.ч., для ароматичних бокових груп (фенілаланін, триптофан, тирозин, гістидин) – від 7 до 9 м.ч.
ПМР-спектроскопія використовується для дослідження взаємодії білкових молекул з лігандами, зокрема, такі їх комплекси як фермент-інгібітор, агоніст-рецептор, з метою виявлення специфічних центрів зв’язування на білках. На прикладі взаємодії рибонуклеази А з інгібітором 3-цитидинмоносфатом (3-ЦМФ) розглянемо експериментальні можливості методу ЯМР ПМР. У цьому ферменті є кілька гістидинових залишків Н-12, Н-48, Н-105 і Н-119, протони яких мають резонанс на різних в нативній рибонуклеазі (рис. 4.24, а). Аналіз проводиться через резонанс протонів у положенні С-2 гістидинових залишків. Додавання інгібітора 3-ЦМФ слабо змінює для Н-48, помітно – для Н-12 і значно – для Н-119 (рис. 4.24, б, в). Резонансна смуга Н-105 не змінює свого положення при взаємодії рибонуклеази А з 3-ЦМФ. За результатами рентгенструктурного аналізу встановлено, що Н-12 і Н-119 перебувають в активному центрі рибонуклеази А і тому ПМР-спектр чітко виявляє зв’язування 3-ЦМФ у цьому центрі.
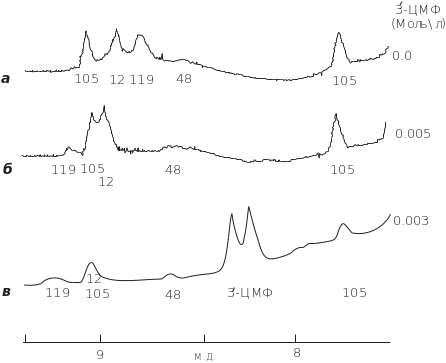
Рис. 4.24. Вплив різних концентрацій інгібітора 3- ЦМФ на ПМР-спектри рибонуклеази а (0,0065 моль/л) у розчині Д2О і 0,2 моль/л NaCl; t = 320C, pH 5,5
б, в
Невеликий зсув протона С-2 в Н-48 є результатом конформаційної перебудови білка завдяки зв’язуванню 3-ЦМФ. Розгортання компактної структури за умов денатурації білків викликає суттєві зміни ПМР-спектрів. Лінії звужуються, оскільки свобода рухів атомних груп зростає, а різні хімічні зсуви , які реєструвалися в нативній рибонуклеазі А, після денатурації білка набувають однакового значення для Н-12, Н-48, Н-105 і Н-119.
ЯМР-томографія. Вода – основний матрикс біологічних об’єктів, а тому основним ЯМР-сигналом тканин є сигнали протонів молекул води. Створюючи у тканині градієнт магнітного поля, отримують спектр ЯМР, в якому інтенсивність сигналу на даній частоті характеризуватиме відносну кількість води у тестованому об’ємі тканини. Біологічний об’єкт таким способом “просвічують”, змінюючи напрямок магнітного поля. Далі за допомогою комп’ютера відтворюється зображення об’єкта за отриманими проекціями. ЯМР-томографія забезпечує можливість відображення різних частин біологічного об’єкта через різні амплітуди сигналів ЯМР. Таким методом визначається локалізація і розмір пухлин в організмі людини. Оскільки намагніченість у пухлинах більша, ніж у нормальних тканинах, сигнал ЯМР води пухлин насичується швидше (час поздовжньої релаксації Т1 незначний), ніж у нормальній тканині. ЯМР-томографія має переваги перед рентгенографією, оскільки магнітне поле та радіочастотне електромагнітне опромінення не викликають пошкодження біологічних об’єктів.
