
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
4.7. Флуоресцентна спектроскопія білків
Флуоресцентна спектроскопія має високу чутливість і широко використовується для вивчення конформаційних станів білків.
Розглянемо фізичну основу флуоресцентного методу. Молекули речовини поглинають кванти світла, енергія Е яких визначається за формулою Планка
Е
= h
= h![]() , (4.
17)
, (4.
17)
де – частота світла; – довжина хвилі світла; с – швидкість світла (с = 2,9979 108 м с-1); h – стала Планка (h = 6,63 10-34 Дж с). Поглинені кванти світла переводять електрони з основного, незбудженого рівня S0 на збуджені рівні S1*, S2*… залежно від енергії кванта (рис. 4.14). Збуджена молекула перебуває в нерівноважному стані, з якого вона має повернутися в рівноважний стан. На схемі (рис. 4.14) стрілками вниз показано різні шляхи дезактивації збудженої молекули. Один з них – це безвипромінювальна дисипація енергії через теплові коливання (хвилясті стрілки). Другий шлях проходить через випромінювання квантів світла (прямі стрілки). Процес, який супроводжується випромінюванням квантів світла при переході електронів між синглетними рівнями S1* S0 (спіни електронів не змінють напрямок), називається флуоресценцією.

Рис. 4.14. Діаграма енергетичних рівнів молекули:
S – синглетні рівні; Т – триплетні рівні; а – поглинання квантів світла; f – флуоресценція; Р – фосфоресценція; n – внутрішня конверсія (безрадіаційні переходи); К – інтеркомбінаційна конверсія; е– електрон
Час життя у збудженому синглетному стані є достатньо коротким і лежить в інтервалі 10-9–10-8 с. Через співудари збуджених молекул із сусідніми молекулами стає можливою переорієнтація спіну, і збуджений електрон переходить (інтеркомбінаційна конверсія) на метастабільний триплетний рівень Т, час життя якого є достатньо тривалим – від 10-7 с до годин. Переходи електронів з триплетних на синглетні рівні (Т1 S0) супроводжуються фосфоресценцією, яка найкраще виявляється в заморожених розчинах.
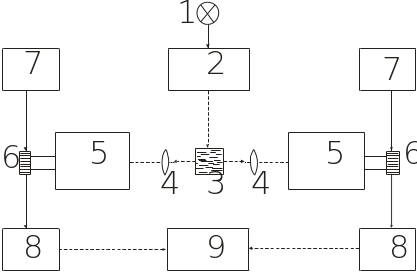
Рис. 4.15. Блок-схема спектрофлуориметра:
1 – джерело УФ-світла; 2 – монохроматор збудження; 3 – кювета з розчином; 4 – фокусуючі лінзи; 5 – монохроматор флуоресценції; 6 – ФЕП; 7 – високовольтний стабілізатор напруги; 8 – підсилювачі; 9 – комп’ютер; 10 – реєструючий пристрій
Флуоресценція різних речовин досліджується на спектрофлуориметрах (рис. 4.15), на яких вимірюються важливі флуоресцентні характеристики. Спектр збудження флуоресценції – залежність інтенсивності флуоресценції І від довжини хвилі збуджуючого світла: І = f(з). Спектр флуоресценції – залежність інтенсивності флуоресценції І від довжини хвилі флуоресцентного випромінювання: І = f(f). Cпектр збудження дещо збігається зі спектром поглинання речовини. За законом Стокса, спектр флуоресценції речовини завжди лежить у більш довгохвильовій спектральній ділянці, ніж спектр збудження чи поглинання. Квантовий вихід флуоресценції – відношення кількості квантів флуоресценції nf до кількості поглинених квантів nа:
=![]() (4.18)
(4.18)
Відносний квантовий вихід речовини визначається за методом Паркера і Ріса. На спектрофлуориметрі в однакових умовах реєструються спектри флуоресценції досліджуваної речовини й еталонної речовини з відомим квантовим виходом 0. Тоді квантовий вихід речовини становитиме
=
0
![]() (4.19)
(4.19)
де S і S0 – площі від спектрами флуоресценції речовини й еталона, відповідно; D і D0 – оптична густина речовини й еталона на довжині хвилі збудження флуоресценції. Як еталони використовуються розчин хініну бісульфату в 1 н Н2SО4 з 0 = 0,55 чи розчин флуоресцеїну в 0,1 н NaОН з 0 = 0,92.
При збудженні молекул лінійно поляризованим світлом спостерігається поляризована флуоресценція, для якої параметрами є ступінь поляризації
Р
=![]() . (4.20)
. (4.20)
чи анізотропія
А
=
![]() (4.21)
(4.21)
де If і If – інтенсивність флуоресценції за паралельного й перпендикулярного розміщення поляризатора й аналізатора, відповідно.
Вимірюючи ступінь поляризації, можна визначити внутрішньомолекулярну рухомість хромофорних груп у білкових молекулах. Ф. Перрен знайшов зв’язок ступеня поляризації Р із часом обертальної релаксації хромофору :
![]() (4.22)
(4.22)
де Р0 – граничний ступінь поляризації, – час життя флуоресценції хромофорної групи.
Флуоресцентна спектроскопія із часовим розділенням. Цей метод дозволяє вивчати швидкі обертальні рухи хромофорних груп чи доменів у білку за час збудженого стану хромофору. Такі рухи вимірюються в наносекундному інтервалі. Фактично вимірюється зміна анізотропії А(t) за час затухання флуоресценції після раптового перекривання збуджувального світла або при збудженні дуже коротким імпульсом світла:
![]() , (4.23)
, (4.23)
де А0 – анізотропія флуоресценції у стаціонарному режимі до перекривання збуджувального світла; с – час обертальної вращательной кореляції хромофору. Експериментально с визначають як час, за який анізотропія А(t) зменшується в е разів. Цей час корелює із часом обертання релаксації хромофору: = 3с.
Зважаючи на те, що тривалість життя флуоресценції хромофору становить десятки наносекунд, час t0 збуджувального імпульсу має бути значно коротшим (t0 < ). У приладах білкова флуоресценція (флуоресценція триптофанових і тирозинових залишків) збуджується пучком лазера, який працює в імпульсному режимі з тривалістю імпульсу t0 < 1 нс. Білковий розчин збуджується лінійно поляризованим світлом. Флуоресценція реєструється через аналізатор, який обертається на 90о з певною частотою, по черзі фіксуючи If і If Електронний пристрій автоматично визначає анізотропію (4.23), і на екрані дисплея реєструється крива A = f(t).
УФ-флуоресценція білка. Білки мають три власні флуоресцентні хромофори – триптофан, тирозин і фенілаланін. Більш інтенсивну флуоресценцію виявляють триптофан і тирозин, фенілаланін флуоресціює слабо. У водному розчині при збудженні з = 295 нм параметри флуоресценції триптофану є такими: максимум спектра флуоресценції max = 353 нм, квантовий вихід = 0,13 і час життя флуоресценції =3,1 нс; для тирозину за з = 275 нм: max = 304 нм, = 0,14 і = 3,6 нс; для фенілаланіну за з = 260 нм: max = 282 нм, = 0,02 і = 6,8 нс.
Флуоресцентні параметри триптофанілів найбільш чутливі до зміни конформації білка. Положення max спектра флуоресценції триптофанілів значною мірою залежить від властивостей їх мікрооточення в білковій глобулі. Якщо триптофанові залишки перебувають на поверхні білкової молекули, в полярному оточенні чи при повній денатурації білка, їхній спектр флуоресценції подібний до спектра флуоресценції триптофану у воді з max = 353 нм (рис.4.16, спектр 1). Спектр флуоресценції триптофанилів, які локалізовані всередині білкової глобули, зсунутий у більш короткохвильову ділянку спектра та його max змінюється в широких межах (від 320 до 342 нм) для різних білків.

Рис. 4.16. Спектри флуоресценції триптофану у воді (1) і альдолази (2) у фосфатному буфері (рН = 7,0; іонна сила – 0,2); Т = 293 К; D280 = 0,2. Збудження флуоресценції 280 нм; І – інтенсивність флуоресценції (спектри нормовані)
На рис. 4.16 наведено спектр флуоресценції альдолази м’язів. Таке короткохвильове положення (max = 323нм) спектра флуоресценції свідчить про високогідрофобне мікрооточення триптофанових залишків усередині альдолази. Найбільш короткохвильове положення спектра флуоресценції (max = 308 нм) спостерігається в азурині.
Конформаційні перебудови білкових молекул зумовлюють зміну розміщення триптофанилів та їхнього мікрооточення, що природно виявиться у спектрі триптофанової флуоресценції. Отже, реєструючи зміни спектра триптофанової флуоресценції білка, можна точно оцінювати його конформаційну перебудову за умови дії факторів середовища (температури, рН, іонної сили тощо) чи у процесі функціонування білків (ферментний каталіз, іонний транспорт, рецепція сигналів та ін.).
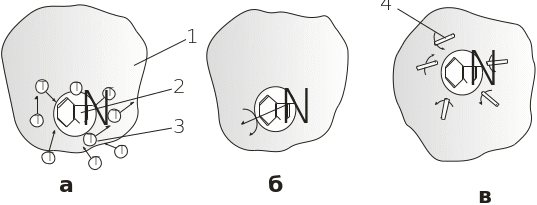
Рис. 4.17. Процеси, які досліджуються флуоресценцією:
а – гасіння флуоресценції; б –поляризація флуоресценції; в – релаксація диполів, які оточують хромофор; 1 – білкова глобула; 2 – індольне кільце триптофану; 3 – гасії флуоресценції; 4 – дипольні групи
Використовуються три методичні підходи до аналізу внутрішньомолекулярної динаміки білків за параметрами власної флуоресценції:
Гасіння флуоресценції триптофанових залишків, які заховані всередині білкової молекули, молекулами-гасіями (Cs+, J-, акриламід, О2), що дифундують у білкову структуру (рис. 4.17, а).
Аналіз обертальних рухів хромофорів через виміряну анізотропію флуоресценції A(t) (4.23) з наносекундним часовим розділенням (рис. 4.17, б).
Дослідження реоріентаційної динаміки дипольних груп, які оточують триптофаніли (рис. 4.17, в). Рухомість дипольних груп зменшує енергію кванта флуоресценції (зміщення max у довгохвильову ділянку спектра) і спричиняє “зникнення“ ефекту червоного краю” (О. Демченко, 1988).
Двохвильовий
флуоресцентний метод.
Положення
спектра флуоресценції триптофанілів
– параметр, який є найбільш чутливим
до конформаційних змін білків. Реєстрація
невеликих спектральних зміщень
проводиться за двохвильовим флуоресцентним
методом. За цим методом точно вимірюється
двохвильовий параметр
![]() – відношення інтенсивностей флуоресценції
на двох фіксованих довжинах хвиль 1
і 2
(рис. 4.16). У нативному білку триптофанові
залишки переважно розміщуються всередині
глобули в гідрофобному мікрооточенні,
й параметр чого?
має велике значення.
– відношення інтенсивностей флуоресценції
на двох фіксованих довжинах хвиль 1
і 2
(рис. 4.16). У нативному білку триптофанові
залишки переважно розміщуються всередині
глобули в гідрофобному мікрооточенні,
й параметр чого?
має велике значення.
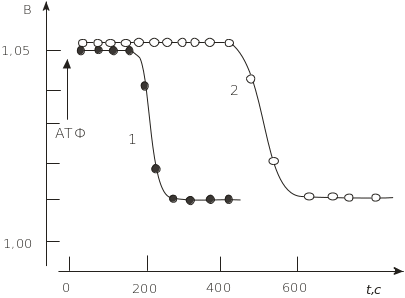
Рис. 4.18. Зміна за часом двохвильового параметра В при гідролізі АТФ міозином: концентрація міозину 0,8 мкмоль/л; MgCl2 – 1 ммоль/л; 1 – 10 мкмоль/л АТФ; 2 – 20 мкмоль/л АТФ; збудження флуоресценції міозину 297 нм; рН = 7,5; Т = 293К
Коли
білкова глобула розгортається і спектр
триптофанової флуоресценції зміщується
в довгохвильову ділянку, тоді параметр
![]() значно зменшується. У спектрофлуориметрі,
який в автоматичному режимі вимірює
параметр В, використовуються два
монохроматори флуоресценції (рис. 4.15
17).
Один монохроматор виділяє
значно зменшується. У спектрофлуориметрі,
який в автоматичному режимі вимірює
параметр В, використовуються два
монохроматори флуоресценції (рис. 4.15
17).
Один монохроматор виділяє
![]() флуоресценції на
1
= 315 нм, а інший –
флуоресценції на
1
= 315 нм, а інший –
![]() на
2
= 370 нм. Цей новий метод виявився достатньо
чутливим для дослідження кінетики
конформаційних змін ферментів при
взаємодії із субстратами. Наприклад,
під час гідролізу АТФ фермент міозин
зворотно змінює свою конформацію, про
що свідчить зміна в часі параметра В
(рис. 4.18).
на
2
= 370 нм. Цей новий метод виявився достатньо
чутливим для дослідження кінетики
конформаційних змін ферментів при
взаємодії із субстратами. Наприклад,
під час гідролізу АТФ фермент міозин
зворотно змінює свою конформацію, про
що свідчить зміна в часі параметра В
(рис. 4.18).
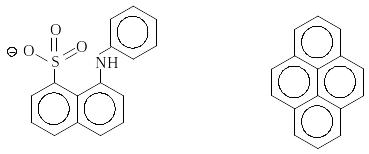
Флуоресцентні зонди. Крім природних білкових хромофорів (триптофан, тирозин, фенілаланін, різні коферменти білків), значну інформацію про структурні особливості об’єкта надають штучні флуоресцентні барвники, які зв’язуються з білками й структурними елементами клітини. Барвники поділяють на флуоресцентні мітки й флуоресцентні зонди. Якщо барвник ковалентно зв’язується з білком чи нуклеїновою кислотою, він виконує роль флуоресцентної мітки. Флуоресцентні зонди – це органічні барвники, які нековалентно, через слабкі взаємодії, зв’язуються з біомакромолекулами й мембранами. Зараз синтезовані й використовуються флуоресцентні зонди для дослідження конформацій білків (АНС 1-анілінонафталін-8-сульфонат, ТНС 2-толуїдиннафталін-6-сульфонат), структури мембран (пірен), мембранних потенціалів (мероціанін), внутрішньоклітинного кальцію (квін-2, фура-2, індо-1, флуо-3) (рис. 4.19).
АНС (1-анілінонафталін-8-сульфонат) Пірен
![]()
![]()
Мероціанін 540
![]()
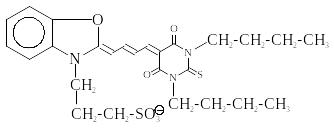

Рис.4.19. Флуоресцентні зонди
У випадку білків флуоресцентні зонди дозволяють вивчати локальні характеристики їх мікрооточення та зміни зонда при конформаційних перебудовах білка, а також механізми його взаємодії з білковими молекулами. Якщо білок має n еквівалентних і незалежних зв’язуючих центрів, тоді взаємодія білка Р і зонда L (чи будь-якого низькомолекулярного ліганду) запишеться таким чином:
P + nL PLn . (4.24)
За умови рівноваги константа асоціації Ка (моль -1) зонда з білком:
![]() n, (4.25)
n, (4.25)
де
[P]0
– концентрація вільного білка; [PLn]
– концентрація комплексу зонд–білок.
Константа дисоціації Kd
комплексу зонд–білок
![]() .
Середня кількість зайнятих центрів r
за умови постійної концентрації
загального білка [P]
= const та за концентрації зонда [L]
становитиме:
.
Середня кількість зайнятих центрів r
за умови постійної концентрації
загального білка [P]
= const та за концентрації зонда [L]
становитиме:
![]() (4.26)
(4.26)
де Y – ступінь насичення зондом кожної білкової молекули. Підставивши із формули (4.25) [PL], формулу (4.26) запишемо таким чином:
![]() (4.27)
(4.27)
Використовуються різні способи перетворення цього виразу у зручну форму для обробки експериментальних даних. В одному випадку (4.27) виражають в обернених величинах:
![]() (4.28)
(4.28)
Це рівняння Хю-Клотца. Його зручно використовувати для визначення характеристик зв’язування зонда з білком. Відомо, що зонди АНС, ТНС практично не флуоресціюють у воді, але в неполярних розчинниках і при зв’язуванні з білком спостерігається яскрава флуоресценція в синій ділянці спектра (для АНС мах = 480 нм). Інтенсивність флуоресценції If у широких межах залежатиме від r:
If = ar, (4.29)
де а – коефіцієнт пропорційності. Домноживши знаменник рівняння (4.28) на а, отримуємо
![]() , (4.30)
, (4.30)
де
Ifmax
=
a n
(максимальна інтенсивність флуоресценції,
коли зондом зайняті всі n
центрів на білку). З графічної залежності
![]() легко знайти Ifmax
і константу Ka.
Інше подання зв’язування зонда (чи
будь-якого ліганду) з білком визначається
через рівняння
Скетчарда:
легко знайти Ifmax
і константу Ka.
Інше подання зв’язування зонда (чи
будь-якого ліганду) з білком визначається
через рівняння
Скетчарда:
![]() . (4.31)
. (4.31)
Експериментальні
дані, наведені в координатах Скетчарда
![]() ,
дають лінійну залежність, з якої знаходять
загальну кількість зв’язуючих центрів
n
і константу Ka.
Величину r
визначають
за методом рівноважного діалізу.
,
дають лінійну залежність, з якої знаходять
загальну кількість зв’язуючих центрів
n
і константу Ka.
Величину r
визначають
за методом рівноважного діалізу.
Метод флуоресцентних зондів дозволяє вивчати рухомість молекул у мембрані за різних фізіологічних станів клітини. Із цією метою використовується зонд пірен. Цей зонд має великий час затухання флуоресценції ( 100 нс), і за цей час можлива дифузія зонда в мембрані на значні відстані. У воді мономерний пірен має характерний спектр флуоресценції з max = 392 нм. У мембрані за умов дифузії збудженої й незбудженої молекул пірену за час може утворитися збуджений димер, так званий ексимер, який характеризується ексимерною флуоресценцією з max = 470нм. Відношення інтенсивностей ексимерної й мономерної флуоресценції If470/If392 буде пропорційним величині коефіцієнта дифузії D пірену в мембрані, що дозволяє оцінювати структурний стан мембрани.
Дослідження мембранних потенціалів флуоресцентними зондами базується на потенціалзалежному розподілі заряджених зондів між зовнішнім розчином і мембраною. Зміна інтенсивності флуоресценції добре корелює зі зміною мембранного потенціалу. Один клас флуоресцентних зондів, зокрема ціанінові (потенціалчутливі флуоресцентні зонди повільної відповіді), використовується для реєстрації мембранного потенціалу та його повільних змін у малих клітинах, інший – зокрема мероціанін (потенціалчутливі флуоресцентні зонди швидкої відповіді) – для реєстрації потенціалів дії нервових і м’язових клітин.
У 80-ті рр. століття? Р. Тсаєн зі співробітниками синтезували кальційчутливі флуоресцентні зонди (квін-2, фура-2, індо-1, флуо-3). Зонди цікаві тим, що одна частина молекули має селективний Ca2+- зв’язуючий центр, близький за типом до ЕГТА, а друга – являє собою флуоресцентний хромофор (рис. 4.19). Просторове розміщення чотирьох карбоксильних груп COO– дозволяє в 105 разів сильніше зв’язувати Ca2+, ніж іони Mg2+. Зв’язування іонів Ca2+ значно змінює флуоресцентні характеристики індо-1, і його max спектра зміщується від 485 нм ( L-вільна форма індо-1) до 415 нм (LM-кальційзв’язана форма індо-1) (рис. 4.20).

Рис. 4.20. Спектри флуоресценції індо-1.
Kонцентрація кальцію, моль/л: 1 – 0; 2 – 10-7; 3 – 10-5; 4 – 10-3; Іф – інтенсивність флуоресценції; збудження 355 нм
Концентрація вільного іонізованого кальцію [Ca2+]i визначається за двохвильовим параметром R. Інтенсивність флуоресценції на двох довжинах хвиль 1 = 410 нм і 2 = 485 нм запишеться як сума двох доданків – флуоресценції L-форми й флуоресценції LM-форми:
![]() (4.32)
(4.32)
де CL і CLM – концентрації L- і LM-форм індо-1, відповідно; SL і SLM –спектральні коефіцієнти. Двохвильовий флуоресцентний параметр R (за аналогією до двохвильового параметра В) визначається як відношення інтенсивностей флуоресценції I1 і I2:
![]() . (4.33)
. (4.33)
Використовуючи
зв’язок між концентраціями й константою
дисоціації Kd
 ,
вираз (4.33) запишемо таким чином:
,
вираз (4.33) запишемо таким чином:
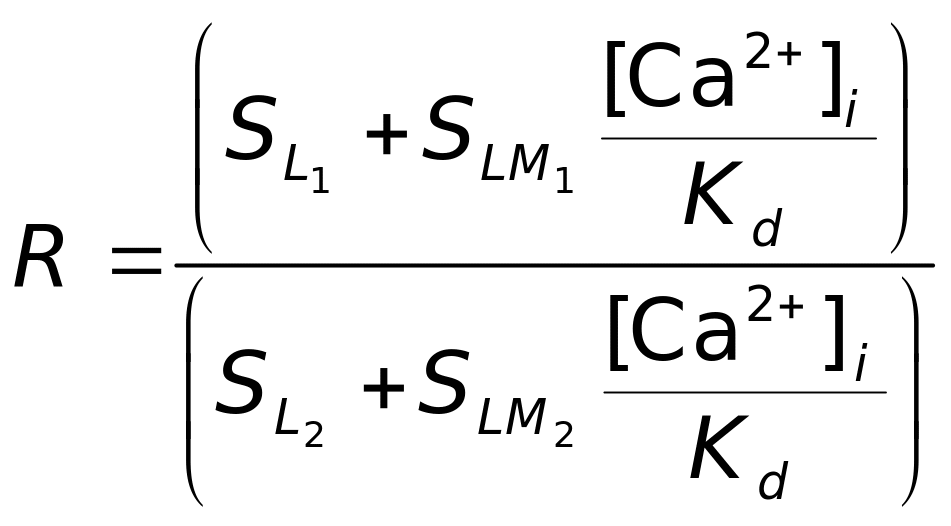 . (4.34)
. (4.34)
Розв’язуючи (4.34) по відношенню до [Ca2+]i, отримуємо концентрацію вільного кальцію:
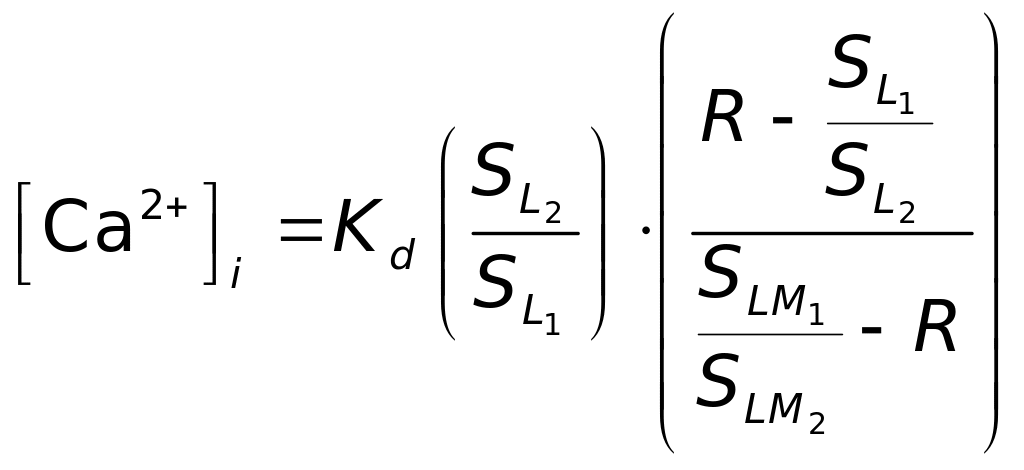 . (4.35)
. (4.35)
Відношення
спектральних коефіцієнтів визначаються
за калібрувальним графіком. У відсутності
іонів кальцію [Ca2+]
= 0 (у розчині 5 ммоль/л ЕГТА) визначається
![]() ;
в умовах насиченого кальцієм розчину
([Ca2+]
=
5 мM)
визначається
;
в умовах насиченого кальцієм розчину
([Ca2+]
=
5 мM)
визначається
![]() ;
;
![]() .
З урахуванням калібрувальних параметрів
вираз (4.35) матиме такий кінцевий вигляд:
.
З урахуванням калібрувальних параметрів
вираз (4.35) матиме такий кінцевий вигляд:
![]() . (4.36)
. (4.36)
Для індо-1 калібрувальні параметри мають такі значення: Rmin = 0,12; Rmax = 2,6; = 2,01; Kd = 250 нмоль/л (Дж. Грінкевич, М. Пуні, Р. Тсаєн, 1985). Концентрація цитозольного Ca2+ за даним методом вимірюється у межах від 10-7 до 10-4 моль/л.
