
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
4.6. Абсорбційна й диференційна спектрофометрія
Спектр поглинання білка в УФ-ділянці (230–310 нм) зумовлено поглинанням ароматичних амінокислот – триптофану, тирозину й фенілаланіну. Світло поглинають хромофорні групи цих амінокислот: індольне кільце у триптофані, фенольне кільце в тирозині й бензольне – у фенілаланіні.
Основним законом абсорбційної спектрофотометрії є закон Ламберта–Бера:
![]() (4.9)
(4.9)
де І – інтенсивність світла, яке пройшло через розчин досліджуваної речовини; Іо – інтенсивність світла, яке падає на кювету; n – кількість молекул в одиниці об’єму; k – ефективна площа поперечного розрізу сечение переріз молекули, яка поглинає кванти світла; l – товщина кювети. Частіше використовується запис цього закону через десяткові логарифми:
![]() (4.10)
(4.10)
де с – концентрація розчину, моль л-1; – коефіцієнт молярної екстинції, моль-1 м-1. Закон Ламберта–Бера в логарифмічній формі записується таким чином:
D = lc, (4.11)
де D – оптична густина розчину. Оптична густина
![]() ,
,
де
Т
– оптичне пропускання розчину. Оптичне
пропускання вимірюють як
![]() .
.
Залежність D чи від довжини хвилі світла називається спектром поглинання: D = f() чи = f(). Залежність Т = f() називається спектром пропускання речовини. Спектральні прилади, на яких вимірюють спектри поглинання або спектри пропускання речовини, називаються спектрофотометрами. На рис. 4.11 зображено блок-схему двопроменевого спектрофотометра.
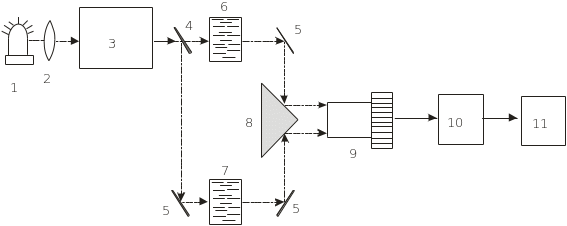
Рис. 4.11. Блок-схема спектрофотометра: 1 – джерело світла; 2 – лінза; 3 – монохроматор; 4 – напівпрозоре дзеркало; 5 – відбиваючі дзеркала; 6 і 7 – кювети з розчином і розчинником, відповідно; 8 – призма; 9 – ФЕП; 10 – підсилювач; 11 – записуючий пристрій
Спектр
поглинання триптофану (рис. 4.12, а)
має максимум max
=
280 нм і незначний пік 290 нм. Коефіцієнт
молярної екстинції 280
= 5,6
105
моль-1
м-1.
Максимум спектра поглинання тирозину
max=
275 нм і 275
=
1,25
105
моль-1
м-1.
Слабе поглинання має фенілаланін max
=
257,5 нм і 275,5
=
0,19
105
моль-1
м-1.
Отже, характерна смуга поглинання білка
з max
=
280 нм становить суму спектрів поглинання
триптофанових, тирозинових і фенілаланінових
залишків:
![]() .
.

Рис.4.12. Спектр поглинання (а) і температурно-пертурбаційний диференційний спектр (б) триптофану у воді (рН = 7,0); градієнт температури Т = 100; D – диференційна оптична густина
За конформаційних змін білкових молекул відбуваються невеликі зміщення спектра поглинання (менше 1 нм), які важко реєструвати на спектрофотометрі. Для підвищення чутливості методу використовується диференційна спектрофотометрія. У цьому методі в кювету порівняння заливається не розчинник (буфер), а розчин білка, і тоді на приладі реєструється диференційний спектр як різниця між спектром поглинання білка у вимірювальній кюветі та спектром поглинання білка в кюветі порівняння. Якщо білок у вимірювальній кюветі не змінює конформацію при дії фізичних (зміна температури) чи хімічних (зміна рН, іонної сили) факторів, то прилад реєструє нульову або базову лінію. Якщо спектр поглинання в кюветі порівняння є D(), а при дії певного фактора у вимірювальній кюветі відбувається зміщення спектра на , і спектр становитиме D( + ), то диференційний спектр буде різницею цих двох спектрів
D() = D( + ) – D(). (4.12)
Якщо розкласти (4.12) в ряд за малим параметром і знехтувати членами другого порядку і вище, то
D()
![]() . (4.13)
. (4.13)
У
першому наближенні диференційний спектр
відповідає першій похідні
![]() від спектра поглинання. Отже, замість
невеликих спектральних зсувів зміщень
,
які важко реєструються, точно вимірюється
величина диференційного поглинання
D()
на чутливих диференційних спектрофотометрах.
На рис. 4.12, б
зображено диференційний спектр поглинання
триптофану. Характерним піком у цьому
спектрі для триптофану, за яким проводиться
аналіз доступних хромофорів у білку, є
пік 293 нм; для тирозину – 286 нм, для
фенілаланіну – кілька піків 268,8; 265,5;
259,5 і 253 нм.
від спектра поглинання. Отже, замість
невеликих спектральних зсувів зміщень
,
які важко реєструються, точно вимірюється
величина диференційного поглинання
D()
на чутливих диференційних спектрофотометрах.
На рис. 4.12, б
зображено диференційний спектр поглинання
триптофану. Характерним піком у цьому
спектрі для триптофану, за яким проводиться
аналіз доступних хромофорів у білку, є
пік 293 нм; для тирозину – 286 нм, для
фенілаланіну – кілька піків 268,8; 265,5;
259,5 і 253 нм.
Методи абсорбційної й диференційної спектрофотометрії широко використовуються для визначення констант рівноваги дисоціації комплексів білок–ліганд, постійних швидкостей асоціації субодиниць у складних білках, процеси денатурації й ренатурації білків тощо. Конформаційний стан білкової глобули оцінюється за диференційною спектрофотометрією через визначення доступних хромофорних груп (триптофанілів чи тирозилів) до зовнішніх пертурбантів. Використовуються два методи диференційної спектрофотометрії.
А. Сольвентно-пертурбаційна диференційна спектрофотометрія. При додаванні до розчину білка 20 % пертурбанту (пертурбанти метанол з ефективним розміром молекули d = 0,28 нм; етиленгліколь (d = 0,44 нм); гліцерин (d = 0,52 нм); глюкоза (d = 0,72 нм); сахароза (d = 0,94 нм)) незначно змінюються оптичні властивості хромофорів, що супроводжується невеликим зміщенням спектра поглинання. Якщо кювету порівняння заповнити розчином білка, а вимірювальну кювету – розчином білка такої самої концентрації з 20 % пертурбанту, то на спектрофотометрі реєструватиметься сольвентно-пертурбаційний диференційний спектр (СПДС). У цьому методі використовуються ще дві тандемні кювети для компенсації додаткового поглинання доданим пертурбантом. Кількість хромофорів у білку (а – триптофанилів, в – тирозилів), на які діє пертурбант, визначається за методом Т. Гершковича і М. Соренсона (1968):
б293 = а Трп293 + в Тир293;
б286 = а Трп286 + в Тир286 , (4.14)
де б293 і б286 – диференційні коефіцієнти молярної екстинції білка на 293 (характерний пік у диференційному спектрі триптофану, рис. 12, б) і 286 нм (для тирозину); Трп і Тир – диференційні коефіцієнти молярної екстинції триптофану й тирозину, які визначаються незалежно в модельних експериментах.
Б. Температурно-пертурбаційна диференційна спектрофотометрія. Розчин білка одинакової концентрації заливається у дві кварцеві кювети, які розміщуються в комірках, через які пропускається вода від термостатів. При створенні різниці температур у двох кюветах реєструється характерний температурно-пертурбаційний диференційний спектр (ТПДС), який являє собою внесок диференційного поглинання триптофанових, тирозинових і фенілалінінових залишків, які під дією температури змінили свої спектральні характеристики. Кожен із хромофорів має свій характерний ТПДС. На рис. 4.12, б наведно ТПДС триптофану, коли в кюветах створюється різниця температур 100 С. ТПДС триптофану, тирозину й фенілаланіну мають характерні піки, дуже близькі за положенням до таких у СПДС.

Рис. 4.13. Температурно-пертурбаційні диференційні спектри:
а – хімотрипсиногену А у фосфатному буфері (0,05 моль/л, рН = 6,8); б – сироваткового альбуміну бика в КСl (0,25 моль/л, рН = 6,75); 1 – ТПДС досліджуваних білків; 2 – ТПДС розчинів N-Ac-Tyr-Oe i N-Ac-Trp-NH2 у молярних співвідношеннях, які відповідають Tyr/Trp у даних білках (а – 4 : 8; б – 18 : 2); D280 =1,0; градієнт температури в кюветах 150С
Паспортною характеристикою хромофору, яка визначається з ТПДС, є температурний інкремент екстинції () (О. Демченко, В. Зима, 1974):
()
=
![]() ,
(4.15)
,
(4.15)
де D() – диференційна оптична густина у ТПДС; Dmax – оптична густина розчину хромофору в максимумі спектра поглинання (для білка 280 нм); t – різниця температур у кюветах. Для триптофану 293 = 1,1 10-3 град-1; для тирозину 287 = 2,12 10-3 град-1; для фенілаланіну 265 = 3,09 10-3 град-1. Частка температурно-пертурбованих хромофорів а (зокрема, триптофанілів) у білку визначається як відношення температурного інкременту екстинції білка б до температурного інкременту екстинції хромофору м
а
=
![]() .
(4.16)
.
(4.16)
ТПДС різних білків значно відрізняються один від одного на відміну від звичайних спектрів поглинання цих білків. На рис. 4.13 наведено ТПДС хімотрипсиногену А і сироваткового альбуміну бика.
