
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
4.4. Диференціальна скануюча мікрокалориметрія
Важливу інформацію про структурну організацію білків дає диференційна скануюча мікрокалориметрія. У цьому методі вимірюється тепло, яке необхідне для неперервного підвищення температури об’єкта на дуже малу величину.
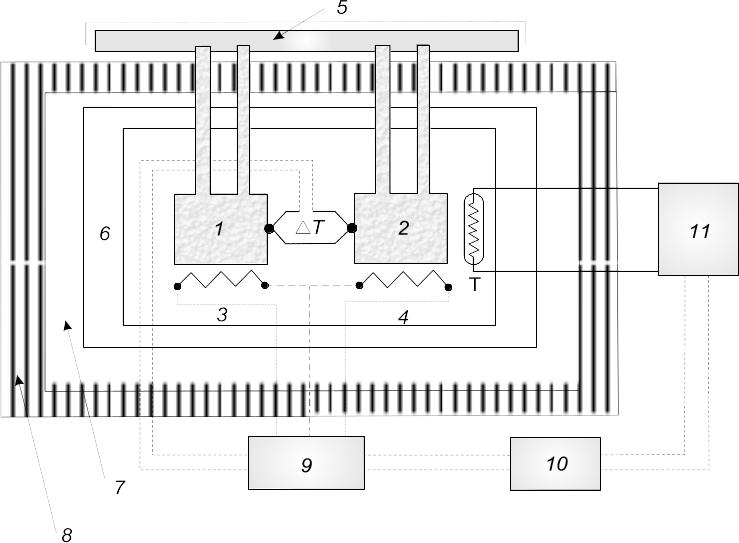
Рис. 4.9. Блок-схема диференційного скануючого мікрокалориметра: 1 і 2 – калориметричні комірки; 3 і 4 – нагрівачі комірок; 5 – камера заповнення комірок; 6 і 7 – адіабатичні екрани; 8 – термоізолюючий екран; 9 – блок нагрівання; 10 – реєструючий пристрій; 11 – індикація температури; Т – різниця температур між комірками
Зміна ентальпії Н при розгортанні макромолекули визначається шляхом вимірювання кількості теплоти, яка необхідна для підтримування однакової температури білкового препарату і контрольного зразка (буферу) при повільному підвищенні температури їх обох. Завдяки наявності контрольного зразка вноситься поправка на зміну теплоємності розчинника. У диференційному мікрокалориметрі (рис. 4.9) розміщені дві ідентичні за масою та об’ємом калориметричні комірки 1 і 2, які підігріваються нагрівачами 3 і 4. Комірки заповнюються розчинами з камери 5. Калориметричний вузол оточують два адіабатичні екрани 6 і 7. Чутливість мікрокалориметра становить 16 10-6 Дж моль-1 град-1.

Рис. 4.10. Криві плавлення й структурна організація фібриногену:
а – доменна будова молекули фібриногену: структурні домени LТ1 і LТ2, НТ1 і НТ2; С – суперспіральні ділянки; П – ділянки розщеплення плазміном; б – криві плавлення фібриногену Ф і його фрагментів Д і Е; Ср – теплоємність
Криві плавлення білків зображуються як температурні залежності теплоємності Cр (рис. 4.10, а). За гіпотезою двох станів (НД) перехід білкової молекули з нативного (Н) у денатурований стан (Д) визначається на кривій плавлення піком CР, якому відповідає температура плавлення білка Тп. Якщо в білку є структурні домени з різною термостійкістю, на кривій плавлення виявляються кілька піків Cр. Наприклад, на кривій плавлення фібриногену реєструють два піки, низькотемпературний з Тп = 328 К і високотемпературний з Тп = 368 К, які належать до термолабільного Д-домену і термостабільного Е-домену, відповідно (рис. 4.10, б).
За П. Приваловим, кооперативність структурних блоків білка може бути оцінено через зміну ентальпії системи. Для цього зіставляють експериментально виміряну калориметричну ентальпію Нкал (за площею під піком теплопоглинання) з ефективною ентальпією Вант-Гоффа Неф, яку визначають за висотою піка Ср за температури плавлення Тп:
![]() (4.
8)
(4.
8)
де
Q
–
площа під піком теплопоглинання. У
цілому має виконуватися така умова
![]() .
Експериментально показано, що для
невеликих білків (лізоцим, рибонуклеаза,
міоглобін)
.
Експериментально показано, що для
невеликих білків (лізоцим, рибонуклеаза,
міоглобін)
![]() .
Це свідчить про те, що денатурація цих
білків відбувається як процес переходу
між двома станами НД
і в таких білках відсутні структурні
домени. У більшості великих за молекулярною
масою білків ( М
20 кДа) процес денатурації проходить
більш складно. Для таких білків, як
імуноглобулін G, плазміноген, фібриноген,
тропоміозин, міозин
.
Це свідчить про те, що денатурація цих
білків відбувається як процес переходу
між двома станами НД
і в таких білках відсутні структурні
домени. У більшості великих за молекулярною
масою білків ( М
20 кДа) процес денатурації проходить
більш складно. Для таких білків, як
імуноглобулін G, плазміноген, фібриноген,
тропоміозин, міозин
![]() .
Це вказує на те, що в цих білках присутні
кілька структурних доменів.
.
Це вказує на те, що в цих білках присутні
кілька структурних доменів.
Розглянемо
структурну![]() організацію
одного з важливих білків згортання
крові – фібриногену (М
=340 кДа). Фібриноген є димерною молекулою,
яка складаєься з двох ідентичних половин.
Кожна з половин молекули має три
неоднакові поліпептидні ланцюги ,
і ,
які з’єднуються разом дисульфідним
вузлом в N-кінцевій
частині фібриногену. На базі
електронно-мікроскопічних досліджень
(Хол,
Слейтер, 1959)
запропоновано тривузолкову
тривузликову
модель фібріногену у вигляді трьох
з’єднаних глобулярних структур. При
плазміновому чи трипсіновому протеолізі
ці структури виділяються як великі
структурні блоки – D-
чи
Д?
та E-фрагменти.
Дані
мікрокалориметрії
показали, що вони плавляться у фібриногені
як незалежні структури з різними
температурами Тп
(рис.
4.10, б).
Ці дані лягли в основу представлення
просторової структури фібриногену у
вигляді одного центрального (Е)
і двох периферійних (Д)
структурно-функціональних доменів.
Пізніше детальне дослідження плавлення
фібриногену та його фрагментів показало,
що у фібриногені міститься більша
кількість незалежних структурних
доменів з упорядкованою компактною
структурою. Підставою для такого
твердження є дані диференційної скануючої
мікрокалориметрії: у високотемпературній
ділянці Тп
=
368 К, де плавиться Е-домен, відношення
організацію
одного з важливих білків згортання
крові – фібриногену (М
=340 кДа). Фібриноген є димерною молекулою,
яка складаєься з двох ідентичних половин.
Кожна з половин молекули має три
неоднакові поліпептидні ланцюги ,
і ,
які з’єднуються разом дисульфідним
вузлом в N-кінцевій
частині фібриногену. На базі
електронно-мікроскопічних досліджень
(Хол,
Слейтер, 1959)
запропоновано тривузолкову
тривузликову
модель фібріногену у вигляді трьох
з’єднаних глобулярних структур. При
плазміновому чи трипсіновому протеолізі
ці структури виділяються як великі
структурні блоки – D-
чи
Д?
та E-фрагменти.
Дані
мікрокалориметрії
показали, що вони плавляться у фібриногені
як незалежні структури з різними
температурами Тп
(рис.
4.10, б).
Ці дані лягли в основу представлення
просторової структури фібриногену у
вигляді одного центрального (Е)
і двох периферійних (Д)
структурно-функціональних доменів.
Пізніше детальне дослідження плавлення
фібриногену та його фрагментів показало,
що у фібриногені міститься більша
кількість незалежних структурних
доменів з упорядкованою компактною
структурою. Підставою для такого
твердження є дані диференційної скануючої
мікрокалориметрії: у високотемпературній
ділянці Тп
=
368 К, де плавиться Е-домен, відношення
![]() ,
а при плавленні Д-доменів
,
а при плавленні Д-доменів
![]() .
Отже, в центральному структурно-функціональному
домені Е
присутні два сильно взаємодіючі
термостабільні домени НТ1
(рис. 4.10, б).
У кожному периферійному
структурно-функціональному домені Д
міститься по три термолабільні домени
LТ1
з
Тп
=
328
К і по одному термостабільному домену
НТ2
з Тп
=
373
К. Термостабільним доменам НТ1
і НТ2
відповідають суперспіральні ділянки
молекули фібриногену. Ще два термолабільні
домени LT2
утворюють С-кінцеві ділянки -ланцюгів.
Ці дані свідчать, що в молекулі фібриногену
присутні 12 більш чи менш незалежних
структурних доменів. Таке доменне
представлення фібриногену має суттєве
значення для розуміння тонких механізмів
утворення фібринових волокон при
згортанні крові.
.
Отже, в центральному структурно-функціональному
домені Е
присутні два сильно взаємодіючі
термостабільні домени НТ1
(рис. 4.10, б).
У кожному периферійному
структурно-функціональному домені Д
міститься по три термолабільні домени
LТ1
з
Тп
=
328
К і по одному термостабільному домену
НТ2
з Тп
=
373
К. Термостабільним доменам НТ1
і НТ2
відповідають суперспіральні ділянки
молекули фібриногену. Ще два термолабільні
домени LT2
утворюють С-кінцеві ділянки -ланцюгів.
Ці дані свідчать, що в молекулі фібриногену
присутні 12 більш чи менш незалежних
структурних доменів. Таке доменне
представлення фібриногену має суттєве
значення для розуміння тонких механізмів
утворення фібринових волокон при
згортанні крові.
