
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
5.9. Біологічна функція нуклеїнових кислот
Реплікація подвійної спіралі ДНК у клітині відбувається за напівконсервативним механізмом. Це означає, що кожна нитка подвійної спіралі ДНК служить шаблоном для синтезу за принципом комплементарності нових спіральних молекул ДНК, повністю тотожних вихідній молекулі.
Розплетення подвійної спіралі ДНК у ході реплікації. Нативні ДНК є двоспіральними; отже, перед реплікацією ланцюга материнської молекули матричні ланцюги ДНК має бути розділено. Цю реакцію здійснюють два типи білків: хелікази та SSB-білки (англ. single strand binding – переклад) – білки, що зв`язуються з однонитковою ДНК. Хеліказами називають ДНК-залежні АТРази, які використовують енергію гідролізу АТР для розплетення подвійної спіралі ДНК. Вважається, що хеліказа рухається за рахунок гідролізу АТР і “їде” по одному з ланцюгів ДНК в одному напрямку, розплітаючи перед собою подвійну спіраль. Існують хелікази, які рухаються від 5′-кінця до 3′-кінця ланцюга ДНК, й інші – що пересуваються в зворотному напрямку. Унаслідок дії хеліказ виникає “реплікативна вилка”, що складається з двоспіральної ділянки ДНК та двох одноланцюгових гілок. Ренатурації одноланцюгових ділянок ДНК перешкоджає їх зв`язування з SSB-білками, що мають вибіркову спорідненість з однонитковою ДНК. Зв`язування одноланцюгової ДНК з SSB-білками активує ДНК-полімеразу, в результаті чого підвищується точність її роботи.
Напрямок синтезу ДНК збігається з напрямком розплетення вихідної подвійної спіралі лише для одного з новосинтезованих ланцюгів (ведучий ланцюг). Другий ланцюг синтезується перервно, порівняно короткими ділянками, що називаються фрагментами Оказакі. Ініціація кожного такого фрагменту Оказакі відбувається лише після того, як утвориться достатньо довга однониткова ділянка ДНК. Таким чином, синтез ДНК на двох матричних ланцюгах вихідної молекули помітно відрізняється. Ланцюг, що синтезується неперервно, називається ведучим, другий – відстаючим (англ. lagging). Кожен фрагмент Оказакі має на 5′кінці кілька рибонуклеотидів – результат дії праймази. Довжина фрагментів Оказакі: для бактерій – 1000 нуклеотидів, еукаріотів – приблизно100. З’єднання коротких фрагментів Оказакі здійснює фермент ДНК-лігаза.
Одна з властивостей ДНК-полімерази I полягає в тому, що фермент не тільки каталізує синтез ланцюга ДНК з його 3′-кінця – затравки, але й викликає в 10 разів повільніше гідролітичне відщеплення нуклеотиду з 3′-кінця (а також і з 5′-кінця). ДНК-полімерази II та III не каталізують цієї реакції. 3′-5′-екзонуклеазна дія дозволяє ДНК-полімеразі І бути в ролі “коректора”. Перед тим, як приєднати наступний нуклеотид, ДНК-полімераза І перевіряє правильність приєднання попереднього. Зараз з`ясовано, що фермент Корнберга, який має назву ДНК-полімераза I, не є ферментом вегетативної реплікації. ДНК-полімераза I – це репараційний фермент, який виправляє дефекти ДНК, що виникли при дії на неї різноманітних хімічних і фізичних факторів. Тому стає зрозумілою відмінність у кінетиці реакції під дією цього ферменту й реакцією вегетативної реплікації. Швидкість останньої реакції вище майже у 100 разів. Число обертів ДНК-полімерази I у реакції вегетативної реплікації становить приблизно106 хв-1, а в реакції in vitro –104 хв-1. Друга характерна риса ДНК-полімерази полягає в тому, що вона добре веде синтез по однонитковій ДНК, доповнюючи її до подвійної спіралі, що саме й потрібно від репараційної полімерази, яка доповнює одноланцюгові відрізки ДНК, використовуючи другу нитку як матрицю.
Транскрипція. Транскрипцію, або синтез мРНК, найбільш детально вивчено на бактеріальних клітинах. Бактеріальна хромосома містить близько 4 000 генів, які можуть транскрибуватися як незалежно один від одного, так і координовано. Незалежна транскрипція гена є можливою, якщо він має власний промотор і термінатор транскрипції. За координованої транскрипції група генів має спільні промотор і термінатор і складає єдину ділянку ДНК. мРНК, що синтезується на загальному промоторі, містить інформацію для синтезу кількох поліпептидів і називається поліцистронною. Група генів, що транскрибуються спільно, – це оперон.
РНК-полімерази бактерій містять чотири субодиниці (, , і ) і утворюють комплекс 2, або повний фермент (холофермент).
Для термінації транскрипції на ДНК існують особливі сигнали – термінаторні послідовності. У цьому випадку термінація здійснюється мінімальним ферментом, але іноді потрібен додатковий білковий чинник – (грец. літера "ро").
У бактеріальній клітині існує дуже багато промоторів, що різняться за нуклеотидною послідовністю й ефективністю ініціації синтезу РНК. Часто їх умовно поділяють на сильні й слабкі. Сильні промотори забезпечують високий рівень синтезу РНК з оперонів, що перебувають під їхнім контролем, а слабкі – відповідно низький рівень. Використання промоторів різної сили є одним із засобів регуляції синтезу РНК у клітині. Кількість синтезованої РНК визначає рівень біосинтезу білка.
Як приклад розглянемо регуляцію лактозного (lac) оперону E. coli, який забезпечує здатність бактеріальної клітини використовувати як джерело вуглецю дисахарид лактозу. Дослідження цього оперону дозволили Ф. Жакобу і Ж. Моно сформулювати концепцію регуляції його роботи (рис. 5.21). Якщо клітини E. coli ростуть у середовищі, що містить лактозу, то в них синтезується фермент -галактозидаза, що гідролізує цей дисахарид до глюкози й галактози, які засвоюються клітиною. Виявляється, якщо джерелом вуглецю для E. coli є глюкоза, то -галактозидаза не синтезується. Проте, якщо в середовище, у якому ростуть клітини, додати аналог лактози, що не гідролізується, – ізопропіл--D-тіогалактозид, то починається (індукується) синтез -галактозидази. Сполуки, що, як лактоза й ізопропил--D-тіогалактозид, здатні індукувати синтез білків (у даному випадку -галактозидази), називаються індукторами.
Механізм індукції -галактозидази добре відомий. У лактозний оперон, крім гена, що кодує -галактозидазу lacZ, входять ще два структурні гени Y і А (рис. 5.21), транскрипція яких відбувається під контролем одного промотору, названого lac-промотором. Ген Z кодує -галактозидазу, ген Y – білок галактозидпермеазу, що забезпечує транспорт галактозидів із середовища у клітину, ген A – фермент тіогалактозид ацетилтрансферазу. Перед lac-опероном міститься ще один ген, названий lacI, що кодує білок-регулятор, здатний міцно зв'язуватися зі спеціальною ділянкою ДНК - оператором У разі відсутності лактози білок гена lacI зв'язується з операторною ділянкою ДНК у безпосередній близькості від промотору й перешкоджає взаємодії з ним РНК-полімерази. Інакше кажучи, білок забороняє (репресує) транскрипцію, тому його названо lac-репресором. При появі в середовищі лактози або іншого індуктора останній зв'язується з репресором, утворюючи міцний комплекс. У результаті репресор відокремлюється від ДНК, звільняючи промотор для взаємодії з РНК-полімеразою. Проте у випадку lac-оперону усунення репресора виявляється недостатнім для того, щоб почалася ефективна транскрипція. У системі бере участь ще один регуляторний елемент, що активує транскрипцію. Активація відбувається за рахунок взаємодії комплексу цАМФ і білка САР (англ. catabolic activator protein – переклад), що зв’язує цАМФ з ділянкою ДНК, що прилягає до промотору з боку, протилежного оператору. Такий тип регуляції називається позитивним.

Рис. 5.21. Будова лактозного оперону E. сoli (а). Механізм регуляції його транскрипції: репресії (б), активації та індукції (в)
Сплайсинг мРНК. У кінці 70 рр. ХХ ст. було встановлено, що синтез мРНК в еукаріотів відрізняється від такого у прокаріотів, що спричинено відмінностями в будові генів. Виявилось, що в багатьох випадках первинні траскрипти мРНК еукаріотів є набагато довшими (до 10 разів), ніж очікувані, якщо виходити з розмірів білків. Це зумовлено тим, що послідовність нуклеотидів у мРНК, яка транслюється в білок, розділена на кілька ділянок послідовностями нуклеотидів, які не кодують білок. Останні ділянки мають назву інтрони, а ті, що кодують білки – екзони. Гени людини можуть мати від 2 до 50 інтронів, довжина яких коливається в межах від 50 до 20 000 пар нуклеотидів. Довжина екзотів, як правило, не перевищує 1000 пар нуклеотидів. Видалення інтронів з первинного транскрипту й об’єднання екзонів з утворенням зрілої молекули мРНК називається сплайсингом (англ. splicing – переклад) (рис. 5.22).
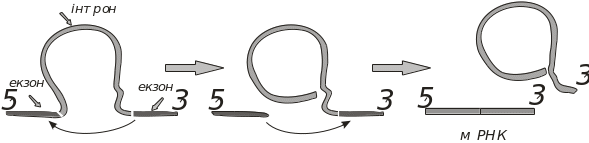
Рис. 5.22. Схема сплайсингу мРНК
Сплайсинг здійснює сплайсома, що складається з кількох малих ядерних РНК (мяРНК, sn RNA) й певної кількості білкових факторів сплайсингу. Роль матриці РНК виконує тільки в цитоплазмі. Перед переходом з ядра в цитоплазму попередники мРНК (15-17 тисяч нуклеотидів) вкорочуються й перетворюються на мРНК (приблизно 2 тисячі нуклеотидів).
Сплайсинг РНК каналізують комплекси білків з РНК, так звані малі ядерні рибонуклеопротеїдні частинки (мяРНП, small nuclear ribonucleic particles, snRNP). Розпізнавання інтронів сплайсомою зумовлено наявністю в останніх специфічних нуклеотидних послідовностей (ГУ-5’ кінець і АГ- 3’-кінець). Але таких сигналів, звичайно, недостатньо для однозначного визначення положень вирізання інтронів й об’єднання екзонів при сплайсингу, оскільки послідовність ГУ і АГ зустрічаються часто усередині як екзонів, так і інтронів. Точний розріз на межі між ними здійснюється за іншими механізмами, і, як показали останні дослідження, важливу роль у цьому процесі відіграють малі молекули РНК. Самі ж механізми сплайсингу й фактори, які його визначають, наразі ще не встановлено.
Альтернативний сплайсинг. Наявність переривчастих генів (екзон-інтронна структура) дозволяє здійснювати альтернативний сплайсинг. Суть останнього полягає в тому, що з одного гена можуть утворюватися різні ізоформи білка (рис. 5.23).
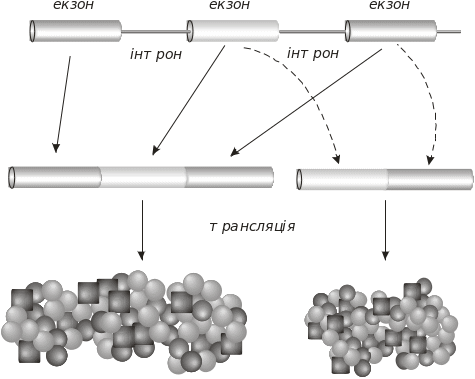
Рис. 5.23. Альтернативний сплайсинг мРНК. Стрілками показано два можливі варіанти сплайсингу
Вибір варіанту сплайсингу визначається білковими факторами, причому альтернативними можуть бути як 5’-, так і 3’-кінці інтрону. Наприклад, ген кальцитоніну криси (має шість екзонів і п’ять інтронів) по-різному експресується залежно від тканини. У зобній залозі він продукує гормон кальцитонін, який регулює вміст кальцію в організмі. У клітинах мозку цей ген продукує нейропептид CGRP (calcitonin gene related protein переклад). Здатність цього гена утворювати різні продукти зумовлено альтернативним сплайсингом, завдяки якому з мРНК –попередника утворюються дві мРНК, які мають однакові 5’-кінці й різні 3’-кінці, що й визначає утворення двох гормонів: кальцитоніну й нейропептиду CGRP.
Альтернативний сплайсинг чітко контролюється відповідно до типу клітин, стадії розвитку організму, а також при вірусних інфекціях. Клітини різного типу складного багатоклітинного організму здатні специфічно контролювати сплайсинг і тим самим забезпечувати синтез подібних, але не ідентичних поліпептидів і білків. Завдяки альтернативному сплайсингу кількість білків в організмі може значно перевищувати кількість генів. Отже, визначення, що таке ген наразі необхідно переглянути у зв’язку з відкриттям альтернативного сплайсингу. Ген можна визначити як ДНК-послідовність, що транскрибується як одне ціле й веде до утворення близьких за структурою поліпептидів (ізоформ білків).
Трансляція. Трансляція полягає в біосинтезі білка по мРНК. Цей складний процес складається з кількох етапів. Перший етап – це реакція активування амінокислот та їх зв’язування з тРНК. Головна функція тРНК – зв’язування амінокислот у хімічно лабільну сполуку, яка може бути транспортована всередину рибосом, де синтезується білок. Встановлено, що у клітині амінокислоти не існують у вільному стані, а зв’язані з полінуклеотидним ланцюгом тРНК. Тому амінокислота не зазнає дії окиснюючих ферментів, сконцентрованих у мітохондріях, тобто просто не “згорають” у клітині як речовини, що постачає енергію. Зрозуміло, що за надлишку амінокислоти частина її залишиться у вільному стані й братиме участь у реакції окиснення.
Перша реакція амінокислоти у клітині полягає у ферментативному утворенні етерного зв’язку з АТФ з відщепленням пірофосфорної кислоти. Це реакція активування амінокислоти. Кожна з 20 амінокислот має свій специфічний фермент, який каталізує цю реакцію. Друга реакція – перенесення амінокислоти на 3-кінцеву групу тРНК.
У всіх 60 видів тРНК, які беруть участь у мобілізації амінокислоти, три кінцеві 3-ланки ланцюга однакові й утворюють послідовність цитозин – цитозин-аденін, а 5-кінець часто містить гуанін. Встановлено, що амінокислота приєднується етерним зв’язком до 2 чи 3 - гідроксилу вуглеводу. Один з доказів полягає в тому, що кінцева рибоза у тРНК при зв’язуванні з амінокислотою не окиснюється йодною кислотою HJO4, яка специфічно атакує в РНК кінцеву рибозу саме по місцю двох сусідніх гідроксилів. Упізнавання тРНК своєї амінокислоти здійснюється за участі ферменту – аміноацил тРНК синтетази.
Отже, стає зрозумілим, навіщо природі знадобилося 20 специфічних ферментів для приєднання до всіх типів тРНК відповідних амінокислот. Ці білки фактично беруть участь у перенесенні генетичної інформації, тому що через них реалізується зв’язок кожної тРНК з власною амінокислотою.
Існує антибіотик пуроміцин, який отруює дуже багато мікроорганізмів, припиняючи в них синтез білка. Експеримент показав, що пуроміцин не діє на перші стадії (активування амінокислот і приєднання їх до тРНК), а припиняє синтез поліпептиду. Пуроміцин є активним за мізерної концентрації – 0,01 мкг/мл. Його будову було встановлено, й виявилось, що це аналог 3-кінцевої групи тРНК. Дія цієї отрути є прикладом дії антиметаболіту, який у силу структурної подібності заміняє молекулу тРНК, прикріплюючись до С-кінця пептиду й тим самим припиняючи подальший ріст ланцюга.
Експериментально встановлено участь тРНК у синтезі білка. Використано сполуку тРНК з амінокислотою – цистеїном, отриману ферментативним шляхом і піддану гідруванню в м’яких умовах на твердому каталізаторі (Ni – Ренея). У результаті цистеїн перетворився на аланін. Подібна сполука при наборі на матриці вела себе не як аланін, а як цистеїн. Таким чином вдалося синтезувати гемоглобін, в якому аланін замінив цистеїн у відповідних ланках ланцюга.
Трансляція – найскладніший багатоступеневий процес синтезу поліпептидного ланцюга. Трансляція здійснюється на рибосомі, в ній беруть участь також білкові фактори, ГТФ і аміноацил - тРНК. Процес трансляції умовно поділяють на три стадії: ініціацію, елогнацію й термінацію. Ініціація трансляції у про- й еукаріотичних клітинах має багато спільних рис. При ініціації рибосоми дисоціюють на субодиниці, й мала субодиниця зв’язується з мРНК й ініціаторною тРНК під дією IF-факторів (IF-1, IF-2, IF-3). До утвореного передініціаторного комплексу приєднується велика субодиниця, IF-фактори відщеплюються, й утворюється зрілий 70s ініціаторний комплекс, готовий до синтезу білка. Але перш ніж утворити передініціаторний комплекс, малій субодиниці рибосоми потрібно знайти місце початку синтезу білка, тобто ініціюючий кодон на мРНК (у загальному випадку це АУГ, але у прокаріотів інколи зустрічається ГУГ або АУУ, причому всі вони зв’язують ініціаторну формілметіонін – тРНК). У структурі будь-якої мРНК послідовність АУГ зустрічається багаторазово, але субодиниця взнає саме той кодон, який відповідає першій амінокислоті білка. У прокаріотів і еукаріотів це впізнавання відбувається по-різному, але в обох випадках інформацію про початок синтезу рибосома одержує від структури мРНК.
Прокаріотичні матриці є поліцистронними й у більшості випадків містять у 5-кінцевій області ділянці ланці , а також у міжцистронних областях послідовності, що не транслюються і яким належить важлива регуляторна роль. Існує гіпотеза Дж. Шайна й Л. Дальгарно (1974), згідно з якою рибосома визначає місце ініціації за допомогою утворення комплексу між 3-кінцевою ділянкою рибосомної 16sРНК і ділянкою мРНК, яка розташована перед ініціюючим кодоном. Еукоріотичні матриці є моноцистронними й містять на 5-кінці “кеп”- структуру, яка визнається одним із факторів ініціації еукоріотичної трансляції.
Елонгація, у свою чергу, складається з трьох головних стадій: зв’язування аміноацил тРНК, утворення пептидного зв’язку й транслокація. У рибосомі умовно виділяють два функціональні центри: А-центр, у якому міститься кожна аміноацил тРНК, що вступає в реакцію, і Р-центр з тРНК, до якої приєднаний пептидний ланцюг, що синтезується (пептидил тРНК)
