
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
Біофізика нуклеїнових кислот
Біологічна значущість нуклеїнових кислот є надзвичайно великою. Історія вивчення цих сполук досить повчальна. Нуклеїнові кислоти відкрив в 1869 р. Мішер. Понад 70 років інтерес до їх дослідження був незначним. І тільки в 50-ті рр. ХХ ст. після того, як було встановлено, що нуклеїнові кислоти відповідають за спадкову інформацію і запропоновано механізм передачі спадкової інформації (модель подвійної спіралі ДНК Дж. Уотсона і Ф. Кріка), почався справжній бум у вивченні нуклеїнових кислот. Зараз, узагальнюючи, можна визначити такі дві основні функції нуклеїнових кислот:
зберігання й передача спадкової інформації;
інструмент, за допомогою якого відбувається біосинтез білків.
Механізми, за яким відбуваються ці процеси, є надзвичайно складними, в них беруть участь багато ферментів і білків, тому функціонування нуклеїнових кислот взаємопов’язане з білками, воно вимагає їх спільної взаємоузгодженої дії. Це приклад вищого рівня організації матерії, на якому важливим є впізнавання на рівні молекул, що залежить не тільки від хімічної будови, але й від їхньої конформацій. Тому зрозуміти молекулярний механізм функціонування цих молекул можливо тільки тоді, коли встановлено їхню просторову структуру на атомному рівні. Вивчення структурних змін, що відбуваються при функціонуванні нуклеїнових кислот – важливий розділ молекулярної біофізики.
5.1. Структура мономерних компонентів нуклеїнових кислот
Нуклеїнові кислоти – це полімери, мономерними одиницями яких є нуклеотиди, які, крім того, самостійно виконують важливу роль в організмі (НАД, НАДФ, цАМФ, АТФ та ін.). Нуклеотид складається з трьох різних за хімічною природою сполук: гетероциклічної основи, вуглеводу й фосфорної кислоти.
До складу нуклеїнових кислот входять п’ять гетероциклічних основ – похідних піримідину (цитозин, тимін, урацил) і пурину (аденін, гуанін) і тільки два моносахариди: D-рибоза й 2-дезокси-D-рибоза (рис. 5.1, 5.2, а).
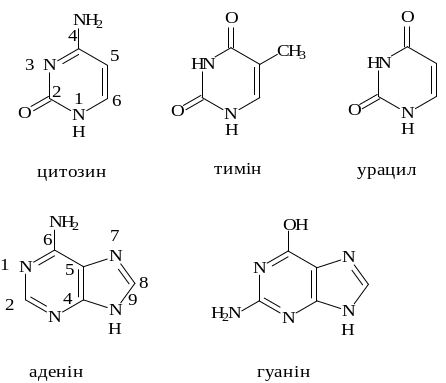
Рис. 5.1. Гетероциклічні основи, які входять до складу нуклеїнових кислот. Цифрами позначено нумерацію атомів
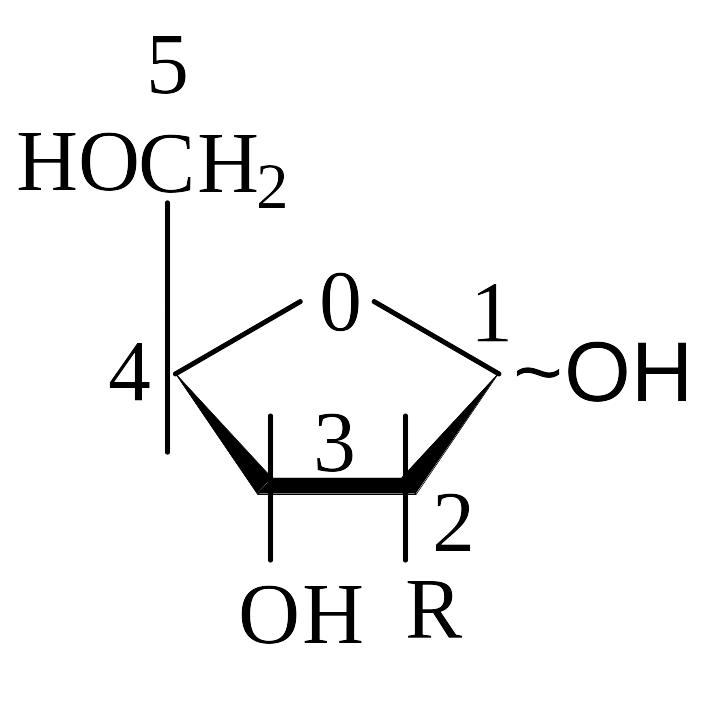
Дослідженнями, проведеними на початку 50-х рр. ХХ ст., було встановлено, що для рибози та 2-дезокси-D-рибози характерною є циклічна фуранозна структура. Залежно від вуглеводу (рибоза або дезоксирибоза) розрізняють відповідно рибонуклеїнові (РНК) і дезоксирибонуклеїнові кислоти (ДНК). Формули Фішера для вуглеводів є занадто громіздкими й відображають просторову форму молекул не досить точно. Тому використовують так звані перспективні формули Хеуерса, в яких вуглеводний ланцюг звернений випуклим боком до спостерігача, а атом кисню фуранозного кільця перебуває на найбільшій відстані від ока спостерігача. Молекулу зображують за законами перспективи (рис. 5.2, а), умовно приймаючи, що молекула має плоску будову.
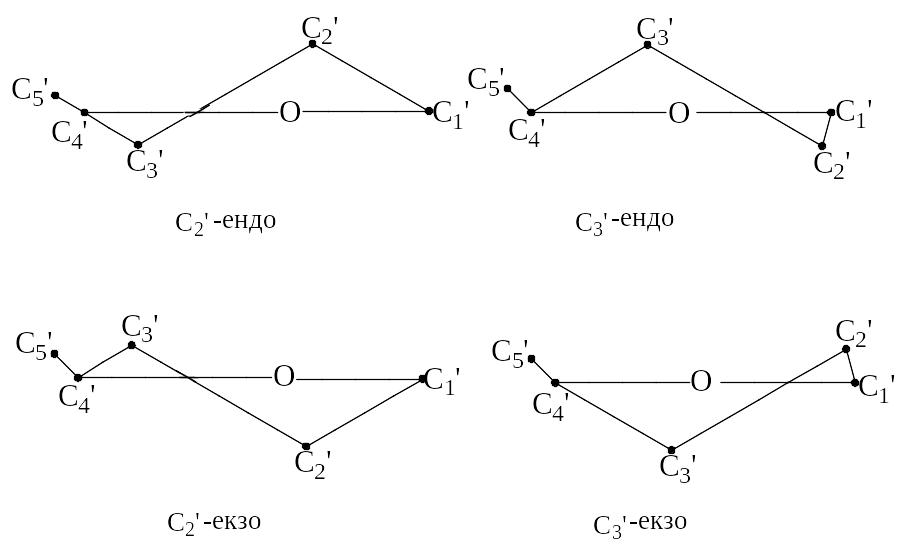
Для вуглеводів, які входять до складу мономерних одиниць нуклеїнових кислот, встановлено, що найчастіше чотири атоми п’ятичленного циклу є приблизно копланарними (лежать в одній площині), а п’ятий атом – С2 або С3 – виведений з площини на 0,5–0,6 Å. Розрахунки показують, що площину зручніше за все проводити через атоми О, С1 і С4. У цьому разі відхилення інших атомів вуглеводного кільця від площини є мінімальними. При цьому, якщо атоми С2 або С3 розташовані по той самий бік площини, що й атом С5, такі конформації називаються ендоконформаціями. Якщо атоми С2 або С3 й атоми С5 розміщені по різні боки від площини кільця, маємо екзоконформації, (рис. 5.2, б).
а
б
Рис. 5.2. інший шрифт, ніж у попередніх розділах Вуглеводні компоненти нуклеїнових кислот. а - R = H – дезоксирибоза, R = OH – рибоза Нумерація атомів вуглеводу у складі нуклеотидів і нуклеозидів позначається зі знаком “штрих”; б – конформації фуранозного кільця вуглеводу
Крім зазначеного викривлення фуранозного кільця, також спостерігається його більш слабка вторинна деформація. Так, якщо С2-розміщено на відстані 0,5–0,6 Å, то С3 - відхиляється на 0,1 Å у протилежний бік від площини кільця.
Більшість структур нуклеозидів і нуклеотидів, які було вивчено за допомогою рентгеноструктурного аналізу мають С2-ендо або С3 -ендоконформацію вуглеводного залишку. Винятком є аденозин-3,5-циклофосфат (цАМФ), конформацію якого можна віднести до С4- екзо типу (рис. 5.3).
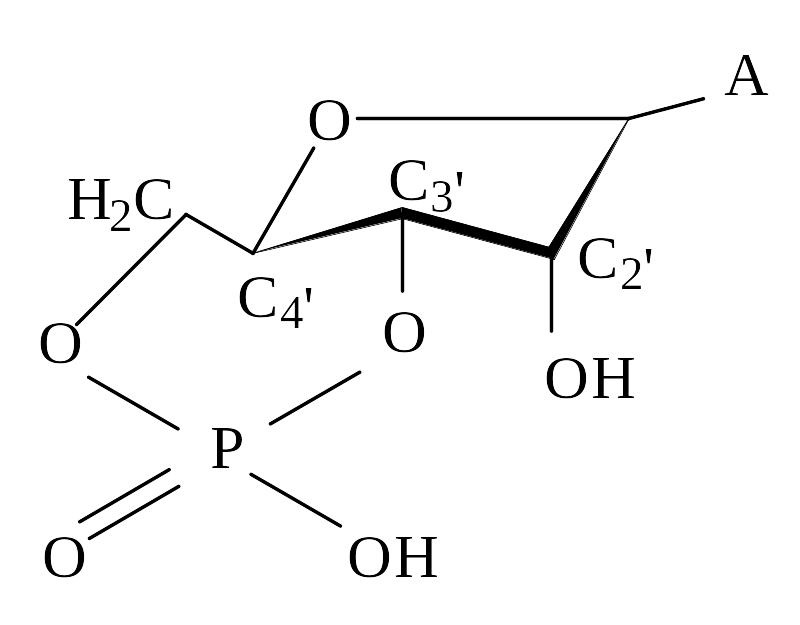
Рис. 5.3. Структура цАМФ
Гетероциклічні основи через атом азоту шляхом утворення глікозидного зв’язку з’єднані з вуглеводом по першому положенню, утворюючи нуклеозид. Атом вуглецю в першому положенні є асиметричним, тобто теоретично можливим є утворення двох стереоізомерів – і .
Таким чином утворюється п’ять нуклеозидів: аденозин, гуанозин, цитидин, тимідин та уридин. Перші чотири входять до складу ДНК. У РНК замість тимідину міститься уридин. Крім перелічених нуклеозидів, до складу РНК і ДНК входять у невеликій кількості інші похідні пурину й піримідину. Такі нуклеозиди називаються мінорними. При фосфорилюванні 2, 3, або 5-гідроксильної групи нуклеозиду утворюється відповідний нуклеотид. Що стосується розміщення фосфатного залишку (р), то в нуклеозид-5-фосфатах атом фосфору розташований, як правило, у транс-положенні по відношенню до атома С4.
Особливість будови нуклеотидів полягає в тому, що вони можуть перебувати в різних таутомерних і конформаційних станах. На рис. 5.4 показано різні таутомерні стани тиміну.
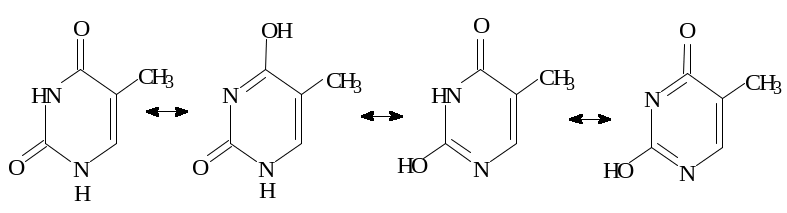
Рис. 5.4. Можливі таутомерні стани тиміну
Невеликі зміни в хімічній будові цих сполук викликають суттєві зміни їхньої біологічної активності, тобто, мало відрізняючись хімічно, ці сполуки в організмі виконують принципово різні біологічні функції. Наприклад, цАМФ регулює перебіг багатьох процесів, а АТФ виконує роль універсального джерела енергії в організмі (біосинтез різних сполук, збудливість, м’язове скорочення тощо).
Поява нового асиметричного атома вуглецю (С1) при утворенні рибофуранозного кільця у випадку D-рибози приводить до утворення двох стереоізомерних форм: -аномера (приєднання основи (аглікону) аксіальне) й -аномера (приєднання аглікону екваторіальне) (рис.5.5).
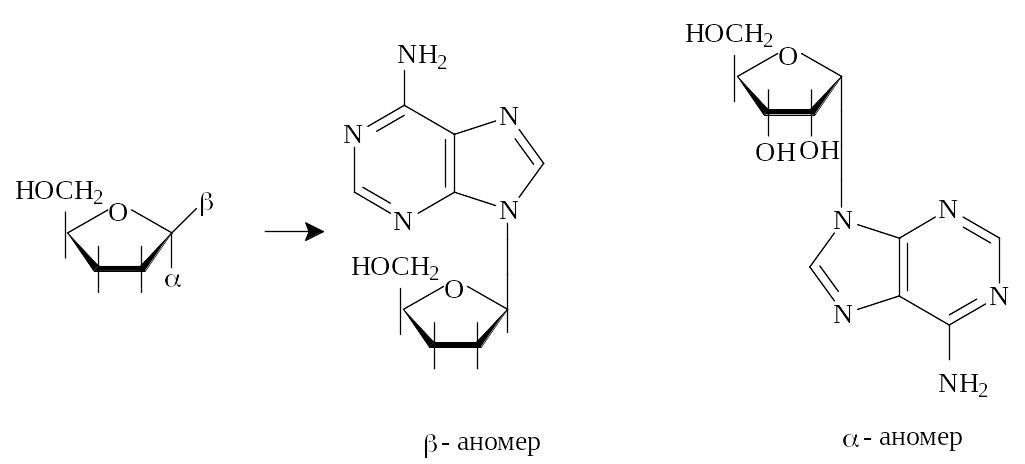
Рис. 5.5. Просторова структура - і -аномерів аденозину
Отже, в -глікозидах аглікон розміщується знизу, а в -глікозидах – зверху від площини кільця вуглеводу, тобто на одному боці з групою СН2ОН.
Тодд і співробітники в 50-ті рр. ХХ ст. за допомогою хімічних методів аналізу встановили, що природні нуклеозиди мають -конфігурацію глікозидного центру. Дані рентгеноструктурного аналізу нуклеозидів підтверджують висновок про -конфігурації глікозидного центру. Його конфігурацію можна визначати за допомогою ЯМР спектроскопії, за рівнянням Карпласа:
![]() , (5.1)
, (5.1)
де J1,2 – константа спін-спінової взаємодії протонів при С1' і С2'; – двогранний кут між С1' – С2' – Н і Н – С2' – С1' у вуглеводу.
Для -аномерів (приєднання основи аксіальне) J1,2 3–5 Гц, для -аномерів (приєднання основи екваторіальне) J1,2 7–9 Гц.
Отже, в нуклеїнових кислотах основи з’єднані із залишком вуглеводу -N-глікозидним зв’язком, а залишки рибози чи 2-дезоксирибози обов’язково належать до D-ряду.
Найважливішою рисою просторової будови нуклеозидів і нуклеотидів є взаємне розміщення залишків основ і вуглеводу, яке характеризується двома параметрами.
Перший параметр – величина двогранного кута () між площинами основи та вуглеводного залишку. Для всіх нуклеозидів і нуклеотидів кут ( 800) наближається до прямого. Двогранний кут можна визначити тільки за допомогою рентгеноструктурного аналізу.
Другий важливий параметр – кут – характеризує взаємне розміщення залишків основи та вуглеводу через кут повороту основи навколо глікозидного зв’язку С1'–N. Спочатку можливі конформації нуклеозидів, які утворюються внаслідок обертання залишків основ навколо глікозидного зв’язку С1'–N, було розглянуто на молекулярних моделях за допомогою так званого методу жорстких сфер. Детальний аналіз за цим методом конформацій піримідинових і пуринових нуклеозидів, а також нуклеотидів дозволив виявити дві ділянки з найменшою внурішньомолекулярною взаємодією. Першій ділянці відповідає кут = +300, другій - –1500. Ці конформації зручно представляти у вигляді ньюменівських проекцій. Спосіб зображення полягає в тому, що спостерігач дивиться в напрямку зв’язку C1–N. Основи розміщені у площині рисунка, а вуглеводи – в перпендикулярній до рисунка площині. C1–О, N–C6 - і т.д. відповідні хімічні зв’язки. Конформації, що відповідають першій ділянці, прийнято називати антиконформаціями, а другій – синконформаціями (рис. 5.6). Як показав рентгеноструктурний аналіз, пуринові та піримідинові нуклеозиди й нуклеотиди у кристалічному стані завжди перебувають в антиконформації. Для більшості сполук значення кута коливається від +400 до +600.
Взаємне розташування залишків основ і вуглеводу нуклеотидів і нуклеозидів у розчині вивчається головним чином спектрополяриметричними методами й методом ЯМР. У першому випадку вивчають дисперсію оптичного обертання (ДОО) чи круговий дихроїзм (КД) розчинів нуклеозидів у УФ-ділянці спектра, де для цих сполук спостерігається характерний ефект Коттона (розділ 4). Оскільки гетероциклічна основа є оптично неактивною, а залишки рибози (чи дезоксирибози) не поглинають УФ-світло в ділянці 230–350 нм, вважають, що знак і величина ефекту Коттона нуклеозидів і нуклеотидів визначається, головним чином, взаємним розташуванням залишків основ і вуглеводу. Піримідинові нуклеозиди та нуклеотиди характеризуються позитивним ефектом Коттона (розділ 4). Важливо, що в піримідинових нуклеозидів із фіксованою антиконформацією ефект Коттона також є позитивним.
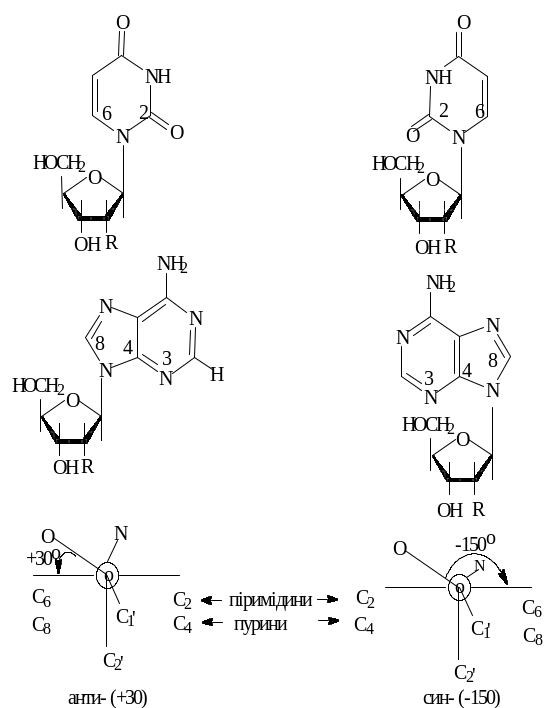
Рис. 5.6. Син- і анти-конформації нуклеозидів. R=H – дезоксирибо-, R=ОH – рибонуклеозиди
Пуринові нуклеотиди в антиконформації мають негативний ефект Коттона з меншою амплітудою, ніж у піримідинових нуклеотидів. Останній факт свідчить про те, що обертання навколо глікозидного зв’язку для пуринових похідних відбувається легше, ніж для піримідинових.
Висновки щодо син- та антиконформації мономерних компонентів нуклеїнових кислот у розчині можна зробити за допомогою методу ЯМР. Сучасний рівень розвитку цього методу дозволяє легко ідентифікувати у спектрах ЯМР піки, які дають протони, зв’язані з певними атомами гетероциклічних ядер. Положення цих піків характеризують величиною хімічного зсуву . Як уже відзначалося, залежно від того, чи перебуває сполука в син- або антиконформації, з атомом С5 (та із фосфатною групою) в нуклеозид-5-фосфатах будуть зближені різні протони гетероциклічної основи. Залежність хімічних зсувів для певних протонів АМФ і його монометилового етеру від рD (розчин у D2О) наведено на рис. 5.7.
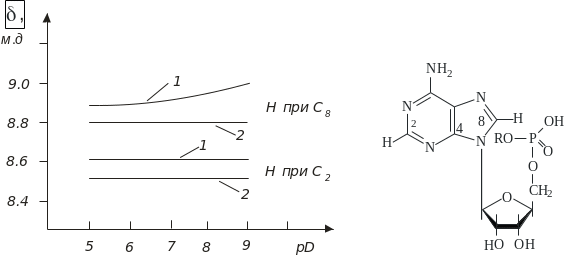
Рис. 5.7. Залежність хімічного зсуву протонів похідного АМФ у положенні 2 і 8. Для залишку фосфорної кислоти рК2 = 6,5 і рК3 = 10,2: 1 – R = H, 2 – R = CH3
Добре видно, що за значень pD 6, коли починається вторинна дисоціація фосфатної групи, відбувається зміна величини хімічного зсуву тільки для атома водню, зв’язаного з С8 (як і слід чекати, у випадку метилового етеру аденозин-5-фосфату ніяких змін не відбувається). Подібний ефект спостерігатиметься лише у випадку, коли АМФ має антиконформацію.
Загальноприйняті символи, які використовуються для позначення структурних елементів нуклеїнових кислот.
Суворе визначення символів, які описують певні структурні елементи нуклеїнових кислот, має принципове значення. Оскільки кількість нуклеотидів, що входять до складу нуклеїнових кислот, невелика, а їхні формули досить громіздкі, то використання символіки є виправданим, і її вживання не викликає неоднозначності, що значно спрощуює виклад відповідного матеріалу (табл. 5.1).
Таблиця 5.1. Скорочення й символи, які використовуються для позначення основ, нуклеозидів і нуклеотидів
Основи |
Нуклеозиди |
Нуклеотиди |
|||
Назва |
Назва |
Символ |
Назва |
Символ |
|
Рибонуклеозиди і рибонуклеотиди |
|||||
Аденін |
Аденозин |
А (А) |
Аденілова кислота |
5 АМФ, або рА |
|
Гуанін |
Гуанозин |
Г (G) |
Гуанілова кислота |
5 ГМФ, або рГ |
|
Тимін |
Тимідин |
Т (Т) |
Тимідилова кислота |
5 ТМФ, або рТ |
|
Урацил |
Уридин |
У(U) |
Уриділова кислота |
5 УМФ, або рУ |
|
Цитозин |
Цитидин |
Ц(С) |
Цитидилова кислота |
5 ЦМФ, або рЦ |
|
Якщо залишок фосфорної кислоти перебуває в положенні 3 вуглеводу, то відповідно символ фосфорної кислоти р стоятиме після символу нуклеозиду, наприклад, Ар – аденозин-3-фосфат. Для позначення 2-дезоксирибонуклеозидів і 2-дезоксирибонуклеотидів використовується символ d, наприклад, рdА – дезоксіаденілова кислота, dЦр – дезоксицитидин-3-фосфат.
