
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
Розглянемо ще один важливий клас ферментів, за участю яких регулюються й контролюються метаболічні процеси у клітині. Метаболіти мають продукуватися в необхідних кількостях і з мінімальними витратами енергії.
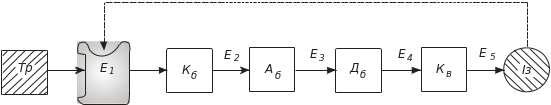
Рис. 4.36. Біологічна регуляція за типом зворотного зв’язку: Тр – треонін; Кб – кетобутират; Аб – ацетогідроксибутират; Дб – дигідроксиметилвалерат; Кв – кето-метилвалерат; Із – ізолейцин; Е1 – треоніндезаміназа; Е2 – синтетаза ацетогідроксикислот; Е3 – ізомероредуктаза ацетогідроксикислот; Е4 – дегідраза дегідроксикислот; Е5 – трансаміназа В
Синтез у клітині амінокислоти L-ізолейцину починається з L-треоніну й проходить через низку проміжних етапів (рис. 4.36). Експериментально виявлено, що активність треоніндезамінази, першого ферменту Е1 на біосинтетичному шляху регулюється кінцевим продуктом – L-ізолейцином. Усі інші ферменти Е2, Е3, Е4 і Е5 не інгібуються L-ізолейцином. Інгібування треоніндезамінази є високоспецифічним: L-лейцин у 100 разів менш ефективний, ніж L-ізолейцин, а ізомер Д-ізолейцин взагалі не інгібує треоніндезаміназу. На базі цих даних запропонований механізм регулювання біосинтезу L-ізолейцину. В інтактній клітині підвищення концентрації L-ізолейцину інгібує треоніндезаміназу. Це спричиняє зменшення швидкості всіх реакцій синтезу L-ізолейцину. Зниження концентрації L-ізолейцину усуває ефект інгібування, що сприяє зростанню швидкості каталітичного перетворення L-треоніну в кінцевий продук – L-ізолейцин. Отже, кінцевий продукт є хімічним сигналом для управління активністю треоніндезамінази. Це приклад регуляції активності ферменту за типом від’ємного зворотного зв’язку. Слід зазначити, що треоніндезаміназа не регулюється за типом конкурентного інгібування. Кінцевий продукт L-ізолейцин структурно не є схожим на L-треонін. Треоніндезаміназа, крім активного центру, в якому каталізується перетворення L-треоніну, має специфічний ефекторний центр, до якого приєднується L-ізолейцин і змінює активність ферменту.
Добре вивчено регуляцію біосинтезу піримідинових нуклеотидів в E.coli. У цій регуляції бере участь складний фермент аспартаттранскарбамоїлаза (АТКаза). Підвищення концентрації цитидин трифосфату (ЦТФ) є інгібуючим сигналом зменшення активності АТКази (відємний зворотний зв’язок). Надлишок АТФ усуває інгібуючий ефект, і відбувається активація АТКази (додатний зворотний зв’язок). Отже, пиримідинові нуклеотиди є специфічними хімічними сигналами, які регулюють активність АТКази.
Регуляторні білки мають низку характерних і важливих особливостей.
Інгібування або активація метаболічними ефекторами відбувається тому, що регуляторні ферменти мають специфічні ефекторні центри, які просторово віддалені від каталітичних центрів. Центри зв’язування ефекторів називаються алостеричними центрами, а ферменти, які мають такі центри, – алостеричними ферментами.
Численні ферменти, активність яких регулюється за алостеричним механізмом, мають S-подібні криві залежності швидкості реакції від концентрації субстрату. Такі алостеричні ферменти виявляють кооперативну кінетику. Кооперативні характеристики добре ілюструються у випадку зв’язування О2 гемоглобіном (рис. 4.37). Міоглобін, який у м’язах використовується для запасання кисню, не виявляє кооперативних властивостей, і його кінетична залежність нагадує ленгмюрівську криву адсорбції.
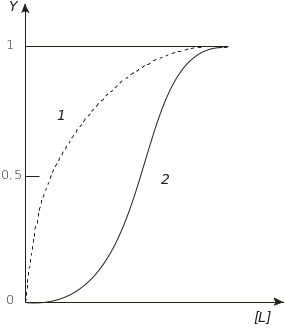
Рис. 4.37. Криві зв’язування кисню міоглобіном (1) і гемоглобіном (2):
Y – ступінь насичення білка; [L] – концентрація ліганду
3. Одна із характерних особливостей білків, які виявляють алостеричні й кооперативні ефекти, полягає в їхній субодиничній будові. Міоглобін – мономерний білок, який складається з одного поліпептидного ланцюга й однієї гем-групи, гемоглобін – із чотирьох субодиниць (дві - і дві -субодиниці), які утворюють тетрамерну структуру із чотирма гем-групами, що зв’язують кисень. Четвертинна структура характерна і для інших алостеричних білків: фосфоліпаза в має дві субодиниці, треоніндезаміназа – чотири.
АТКаза (М = 300 кДа) є мультисубодиничним білком, який складається з двох каталітичних (К) тримерів (М = 100 кДа) і трьох регуляторних (Р) димерів (М = 34 кДа) (рис. 4.38).
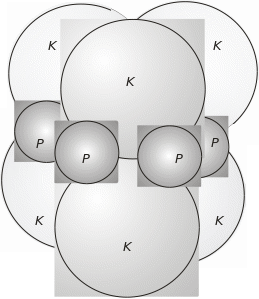
Рис. 4.38. Схематичне розміщення субодиниць в аспартаттранскарбамоїлазі (АТКазі): ККК – каталітичні тримери; РР – регуляторні димери
Методом рентгеноструктурного аналізу визначено атомну, тримірну структуру АТКази з розділенням 0,3 нм. У зоні контакту між К- і Р-субодиницями розміщуються атоми цинку. Фермент має шість каталітичних і шість алостеричних центрів. Ефекторні центри, які розташовані на Р-субодиницях, віддалені на 6 нм від каталітичних центрів, які локалізовані на К-субодиницях. Отже, вплив ЦМФ і АТФ на активність АТКази справляють конформаційні зміни ферменту, які передаються від Р- до К-субодиниць, викликаючи алостеричні й кооперативні ефекти.
Зв’язування ліганда L мономерним білком Е здійснюється за схемою
![]() (4.103)
(4.103)
де К – константа асоціації. В умовах рівноваги
![]() . (4.104)
. (4.104)
Уводиться параметр Y ступінь насичення білка лігандом, тобто відношення кількості зв’язуючих центрів, які зайняті лігандом за даної концентрації [L], до загальної кількості зв’язуючих центрів:
![]() . (4.105)
. (4.105)
Підставивши [EL] з (4.104), отримуємо
![]() (4.106)
(4.106)
Вираз (4.106) нагадує рівняння Міхаеліса–Ментен (4.68) і представляє ізотерму Ленгмюра. Експериментально виміряна ступінь насичення Y міоглобіну залежно від концентрації кисню описується рівнянням (4.106) (рис. 4.37, крива 1).
На відміну від міоглобіну, ступінь насичення Y гемоглобіну киснем описується S-подібною кривою (рис. 4.37, крива 2). Така залежність для гемоглобіну добре описується рівнянням Хілла (1910)
![]() , (4.107)
, (4.107)
де h – коеффіцієнт Хілла. Перетворимо (4.107) таким чином:
![]() . (4.108)
. (4.108)
Прологарифмуємо
(4.108) і отримаємо лінійну залежність
![]() від
від
![]() (графік
Хілла) (рис. 4.39):
(графік
Хілла) (рис. 4.39):
![]() . (4.109)
. (4.109)
З графіка Хілла легко визначаються два параметри – K i h. Коеффіцієнт Хілла h широко використовується як параметр, який характеризує ступінь кооперативності. Якщо h = 1, кооперативність відсутня, тоді приходимо до (4.106). Якщо h > 1, тоді спостерігається позитивна кооперативність. Для гемоглобіну h = 2,8. Чим більше h, тим вища кооперативність. У гемоглобіні зв’язування молекули О2 з одним з гемів полегшує таке зв’язування О2 з іншими гем-групами. Якщо h < 1, спостерігається негативна кооперативність.

Рис. 4.39. Графік Хілла
Для пояснення функціонування алостеричних ферментів запропоновані дві моделі.
Симетрична (алостерична) модель Моно–Уаймена–Шанже (1965). Розглянемо тетрамерний алостеричний білок, який складається із чотирьох субодиниць. У симетричній моделі постулюється, що субодиниці алостеричного ферменту можуть перебувати у двох конформаціях – напруженій (Т-стан) і релаксованій (Р-стан) (рис. 4.40, а).

Рис. 40. Моделі фунціонування алостеричних ферментів: а – симетрична модель; б – послідовна модель; Р і Т – релаксований і напружений стан ферменту
У субодиниці білка завжди мають одинакову конформацію. У рівновазі алостеричний білок перебуває у двох конформаціях: у Т-стані з низькою спорідненістю до ліганду L, й у Р-стані з високою спорідненістю до L. За відсутності L рівновага змішена в напрямку напруженої конформації, й переважає Т-стан ферменту. Коли L зв’язується з тетрамером, рівновага швидко зсувається в Р-стан ферменту. За цією моделлю перехід з Т- в Р-стан відбувається узгоджено, тобто конформація всіх субодиниць змінюється одночасно. Ця модель добре пояснює S-подібні криві.
Послідовна модель Кошланда–Неметі–Філмера (1966). Суттєвою особливістю цієї моделі є припущення про те, що зв’язування ліганду спричинює кілька послідовних структурних змін в алостеричному білку. Зв’язування L з першою субодиницею індукує в ній конформаційні зміни, які передаються на сусідню субодиницю. Індукована у другій субодиниці конформаційна зміна забезпечує більш легке зв’язування другої молекули L (рис.4.40, б). Після зв’язування другої молекули L продовжується вплив на конформацію інших субодиниць. Отже, конформаційні зміни відбуваються послідовно, через кілька проміжних станів з більшою чи меншою константою асоціації. Послідовна модель має перевагу в тому, що вона може пояснити негативну кооперативність: зв’язування першої молекули L індукує таку конформаційну зміну субодиниці, за якої значно полегшується зв’язування іншої L.
Розділ 5.
