
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
4.10. Ферментний каталіз
У живому організмі відбувається величезна кількість оборотних обернених хімічних реакцій: гідроліз, розщеплення хімічних зв’язків, утворення нових речовин, ізомерізація, перенесення електронів і протонів тощо. Великих швидкостей біохімічних реакцій неможливо досягти простим збільшенням температури чи тиску. Прискорення хімічних перетворень у клітині зумовлено функціонуванням природних каталізаторів – ферментів, які працюють за фізіологічних температур, іонних сил і рН.
Деякі особливості характеризують функціонування білків-ферментів. Першою надзвичайно важливою особливістю роботи ферментів є ефективність їхньої каталітичної дії. Каталізовані ферментами реакції проходять зі швидкостями в 108–1015 разів більшими, ніж відповідні некаталізовані реакції. Друга особливість ферментів визначається їхньою високою специфічністю дії на субстраті.
Якщо виходити із цих особливостей, виникає низка важливих запитань: 1) Як працюють ферменти, прискорюючи з такою ефективністю хімічні перетворення? 2) Яким є механізм взаємодії ферменту із субстратом і як пояснити високу специфічність дії ферментів?
Ці питання впродовж багатьох десятиліть досліджуються в різних лабораторіях. За термодинамічним підходом, основна функція ферментів зводиться до зниження енергетичних бар’єрів хімічних реакцій, які мають значну величину у випадку неферментативних перетворень. Наприклад, неферментативне розщеплення перекису водню відбувається з великою енергією активації Еа 75 кДж моль-1. За участі ферменту каталази енергетичний бар’єр знижується до 8 кДж моль-1, завдяки чому швидкість цієї реакції зростає в 3 1011 разів.
Механізм специфічності, без сумніву, має визначатися принципом комплементарності між активним центром ферменту й субстратом. Зв’язуючий центр ферменту є комплементарним за формою, за полярністю й зарядом до певних ділянок субстрату, які виконують роль упізнавальних елементів. На самому початку специфічність, за Е. Фішером, пояснювалася через жорстку пригонку субстрата до активного центру ферменту (модель “ключ–замок”). Із часом накопичувалося все більше фактів про хибність статичної моделі Фішера. Виявилося, що малі за розміром молекули, які легко проникають в активний центр, слабо каталізуються, тоді як молекули більшого розміру легко зв’язуються й дуже ефективно перетворюються в активному центрі. Ці та інші факти, які було наведено у підрозділі 4.5, стали базовими для опису каталітичних реакцій за участю ферментів як динамічних біомакромолекул.
Д. Кошланд запропонував механізм індукованої структурної відповідності ферменту й субстрату. За цим механізмом субстрат спричинює суттєві конформаційні зміни ферменту, коли він проникає в активний центр. Через конформаційну перебудову активного центру відбувається точна орієнтація каталітичних груп ферменту для перетворення субстрату. За механізмом Кошланда чітко розділяються два процеси – зв’язування субстрату та його каталітичне перетворення.

Рис. 4.27. Схема взаємодії ферменту Е й субстрату S за механізмом індукованої структурної відповідності: а – вільний фермент; б – фермент-субстратний комплекс; 1 – каталітичні групи; 2 – групи, відповідальні за зв’язування субстрату
Каталітичні групи 1 активного центру вільного ферменту не зорієнтовані для каталітичної дії (рис. 4.27, а). Після зв’язування субстрату з ферментом відбуваються конформаційні зміни в активному центрі, завдяки чому каталітичні групи набувають необхідної для каталізу орієнтації (рис. 4. 27, б). Збільшення швидкості реакції за участю ферменту полягає в тому, що мало ймовірні реакції високого порядку, які вимагають співударів трьох і більше реагуючих атомних груп, заміняються на високоефективні реакції низького порядку. Теорія Кошланда базується на динамічній відповідності ферменту й субстрату: не тільки фермент впливає на структуру субстрату, але й сам субстрат індукує конформаційні зміни ферменту. Фермент-субстратні взаємодії спричиняють фіксацію й дестабілізацію субстрату. Обертальні й поступальні ступені вільності субстрату ефективно “виморожуються”, коли він зв’язується із ферментом, отже, стеричні вимоги реакції повністю задовольняються. Один цей ефект може забезпечити помітне зростання швидкості реакції. Зв’язування із ферментом зумовлює конформаційну й електронну дестабілізацію субстрату. Розщеплення хімічного зв’язку полегшуватиметься, якщо зв’язок “розтягується”, коли молекула зв’язується із ферментом. Така конформаційна дестабілізація відіграє важливу роль при розщепленні пептидних зв’язків сериновими протеазами, які створюють інтермедіат з тетрагональним карбонільним вуглецем. Зв’язування субстрату з протеазою спричинює тетрагональне викривлення зв’язків атома С, який спочатку мав нормальний пептидний зв’язок. Це призводить до послаблення пептидного C-N-зв’язку й сприяє поляризації атома С.
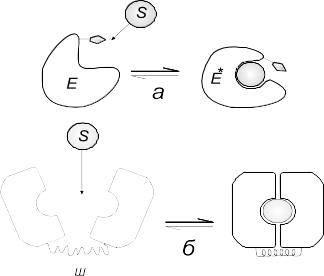
Рис. 4.28. Конформаційні зміни ферменту, викликані зв’язуванням ліганду:
а – локальні конформаційні зміни в ділянці активного центру; б – великомасштабні міждоменні рухи; Е – фермент; S – субстрат; ЕS – фермент-субстратний комплекс; Ш – “шарнірне” з’єднання
Динаміка білкової структури відіграє суттєву роль у функціонуванні ферментів. За статичного положення атомів білків субстрати не могли б проникнути в центри зв’язування, а продукти реакції – швидко залишати активні центри.
У відсутності зв’язаного субстрату фермент перебуває в рівновазі з двома (або більше) різними конформаційними станами, з яких один може бути найкращим для субстрату. Зв’язування субстрату зміщує рівновагу в напрямку найбільш вигідної конформації ферменту. За допомогою рентгеноструктурного аналізу високого розділення виявлено кілька конформаційних перебудов, які спричиняються зв’язуванням субстрату. Перший тип – це невеликі, локальні конформаційні перебудови, які зачіпають тільки ділянки активного центру. Для таких дрібномасштабних конформаційних змін характерні невеликі локальні зміщення атомних груп – не більше 1,5 нм. Як виявлено в карбоксипептидазі, тирозиновий залишок 248 цього ферменту зміщується на 1,2 нм при переході зі стану вільного ферменту до конформаційного стану, коли субстрат зв’язується в активному центрі (рис. 4. 28, а).
Інший тип включає великомасштабні конформаційні перебудови, коли відбуваються зміщення окремих структурних доменів ферменту на значні відстані – більше 1,5 нм. Зв’язування субстрату гексокіназою спричинює суттєву реорієнтацію двох доменів, хоч конформація самих доменів змінюється незначно (рис. 4.28, б). Слабко впорядкований поліпептидний ланцюг, який зв’язує два домени, виконує роль “шарніру”. У багатьох складних ферментах субстрати зв’язуються у глибокій щілині, яка лежить між доменами, як виявлено це в голівці міозину, в алкогольдегідрогеназі тощо. Алкогольдегідрогеназа (М ~ 80 кДа) має четвертинну структуру й складається з двох великих субодиниць, поліпептидний ланцюг кожної з яких утворює два структурні домени. У НАД-залежній дегідрогеназі один домен використовується для зв’язування коферменту НАД, а другий – для зв’язування субстрату (лактата, малата). Активний центр алкогольдегідрогенази – це щілина (“кишеня”), яка лежить між доменами. Кофермент НАД зв’язується на ділянці домену, яка виявляє гідрофобні властивості, тоді як субстрати, які зв’язуються на іншій частині “кишені”, потрапляють у гідрофільну ділянку активного центру. Рентгеноструктурний аналіз показав, що алкогольдегідрогеназа може перебувати у двох конформаціях. Одна з них – відкрита конформація, яка властива апоферменту (відсутній кофермент). У закритій конформації домени стискуються, внаслідок чого зв’язаний НАД і субстрат зближуються, а далі дуже швидко гідрид-іон (Н+) переноситься на нікотинамід. Після завершення хімічної реакції фермент завдяки динамічній зміні структури знову набуває відкритої конформації (домени розходяться), і продукти реакції звільняються з активного центру.
Більша
частина енергії, яка виділяється при
зв’язуванні субстрату, витрачається
на зміну конформації ферменту. Типовим
прикладом є аденілатциклаза, яка
фосфорилює свій специфічний субстрат
АМФ у 105
разів швидше, ніж молекули Н20.
Експериментально було визначено
константу асоціації Ка
аденілатциклази з АМФ
![]() і з Н20
і з Н20![]() .
За відомою формулою (1.37)
G
= -R T lnK
оцінювалась зміна вільної енергії
зв’язування. За Т
=
300 К у випадку специфічної взаємодії
АМФ Gф
= -22,9 кДж
моль-1,
а для молекул Н20
G0
= -51,6 кДж
моль-1.
При зв’язуванні специфічного субстрату
енергія зв’язування зменшується більш
ніж у два рази. Отже, значна частина
енергії зв’язування витрачається на
забезпечення зміни конформації ферменту
від неактивної до активної форми, за
якої проходить каталітичний процес.
.
За відомою формулою (1.37)
G
= -R T lnK
оцінювалась зміна вільної енергії
зв’язування. За Т
=
300 К у випадку специфічної взаємодії
АМФ Gф
= -22,9 кДж
моль-1,
а для молекул Н20
G0
= -51,6 кДж
моль-1.
При зв’язуванні специфічного субстрату
енергія зв’язування зменшується більш
ніж у два рази. Отже, значна частина
енергії зв’язування витрачається на
забезпечення зміни конформації ферменту
від неактивної до активної форми, за
якої проходить каталітичний процес.
Важливим етапом у теоретичному дослідженні взаємодії ферменту із субстратом стало комп’ютерне моделювання динаміки білкової структури (Карплус, мак-Каммон, 1983). Використовуючи дані рентгеноструктурного аналізу, задают початкові координати та імпульси кожного атома, а далі вивчають їхні рухи за законами класичної механіки. Зв’язки між атомами визначаються через сили пружності. Процес моделювання складається із численних малих кроків тривалістю 10-15с, на кожному з яких розраховуються зміни координат і швидкості.
Виконавши серію таких розрахунків для численних кроків, на дисплеї комп’ютера отримують картину внутрішньомолекулярного руху білкової структури впродовж значного інтервалу часу – до 10-9 с. Значні рухи для окремих атомів через щільну упаковку поліпептидного ланцюга всередині білкової глобули можливі тільки тоді, коли вони супроводжуються скоординованими рухами сусідніх атомів. Найбільші зміщення відбуваються на поверхні глобули, де стеричні обмеження значно менші. Флуктуації атомів всередині білкової глобули не перевищують 0,05 нм, тоді як на поверхні глобули вони досягають 0,2 нм. Основний внесок у середньоквадратові зміщення атомів роблять флуктуації, які відбуваються за 0,2–10 пс.
Комп’ютерне моделювання динаміки структури алкогольдегідрогенази показало, що перехід цього ферменту з відкритої конформації у закриту супроводжується обертанням доменів навколо “шарніру” на 300. Якщо б домени мали абсолютно жорстку структуру, то для їх обертання й зближення необхідно було б долати великий енергетичний бар’єр – порядку 4200 кДж моль-1. За фізіологічних температур теплової енергії атомів недостатньо для подплання такого бар’єра. Але повільне обертання доменів супроводжується швидкими флуктуаціями атомної структури, завдяки чому енергетичний профіль обертання стає більш пологим і теплової енергії достатньо для забезпечення великомасштабного зміщення доменів.
Таким чином, невеликі високочастотні (пікосекундні) флуктуації білкової структури відіграють важливу роль у великомасштабних повільних (більше 10-9 с) зміщеннях доменів. Динаміка білкової структури має вирішальне значення у ферментному каталізі.
