
- •Розділ 4. Біофізика білків
- •4.1. Первинна й вторинна структура білків
- •4.2. Дисперсія оптичного обертання (доо) і круговий дихроїзм (кд)
- •4.3. Домени й третинна будова білків
- •4.4. Диференціальна скануюча мікрокалориметрія
- •4.5. Динаміка структури білків
- •4.6. Абсорбційна й диференційна спектрофометрія
- •4.7. Флуоресцентна спектроскопія білків
- •4.8. Ядерний магнітний резонанс (ямр)
- •4.9. Електронний парамагнітний резонанс (епр)
- •4.10. Ферментний каталіз
- •4.11. Кінетика ферментативних реакцій
- •4.12. Вплив температури на швидкість біохімічних реакцій
- •4.13. Алостеричні ферменти. Регуляція хімічних реакцій у клітині
- •Біофізика нуклеїнових кислот
- •5.1. Структура мономерних компонентів нуклеїнових кислот
- •5.2. Первинна структура нуклеїнових кислот
- •5.3. Вторинна структура днк
- •5.4. Конформації подвійних спіралей нуклеїнових кислот
- •5.5. Структура тРнк
- •5.6. Рівні компактизації днк
- •5.7. Оптичні характеристики і гіперхромний ефект днк
- •5.8. Ренатурація й кінетика ренатурації денатурованої днк
- •5.9. Біологічна функція нуклеїнових кислот
- •5.10. Клонування днк
- •5.11. Нуклеїново-білкове впізнавання
Розділ 4. Біофізика білків
Усі процеси у клітині відбуваються за участю білків, які виконують численні функції. Структурні білки утворюють з’єднувальну тканину, входять до складу шкіри та інших органів. Неможливо уявити роботу генетичного апарату без участі білків, завдяки яким відбувається реплікація, транскрипція й трансляція інформації. У регуляторних процесах важлива роль належить гормонам, які передають різні сигнали, і білкам – рецепторам, які впізнають ці сигнали. Транспортні білки відповідають за перенесення незаряджених молекул та іонів через мембрани клітини. Спеціальний клас білків виконує передачу електронів у мембранах мітохондрій і хлоропластів. Клітинна рухомість і м’язове скорочення забезпечуються роботою скоротливих білків. Важлива роль належить ферментам, які каталізують і регулюють метаболічні процеси у клітині.
Унікальні властивості білків визначаються особливостями їхньої просторової структури, яка залежно від послідовності одних і тих самих амінокислотних залишків може суттєво відрізнятись. Завданням молекулярної біофізики є дослідження структурної організації білків і розкриття тих механізмів, за якими білки виконують ту чи іншу функцію.
4.1. Первинна й вторинна структура білків
Білки – це динамічні структури, які зазнають певних конформаційних змін у процесі біологічного функціонування. Аналіз конформацій проводиться, виходячи з різних рівнів організації білкових молекул. Ще в 1959 р. К. Ліндерштрем-Ланг виділив чотири рівні структурної організації білків – первинну, вторинну, третинну і четвертинну структуру. Пізніше на основі аналізу даних рентгенографії, диференційної скануючої мікрокалориметрії та інших методів було виділено ще два рівні організації – надвторинні структури й домени білків (Шульц, Шірмер, 1982).
Амінокислотна послідовність у поліпептидному ланцюгу становить первинну структуру білка. Встановлення послідовності амінокислотних залишків у білку є важливим етапом дослідження його структури. Зараз цей аналіз проводиться автоматично секвенаторами. В останні роки використовується інший метод визначення амінокислотної послідовності. Виділяють фрагмент ДНК, який включає структурний ген даного білка, розшифровують послідовність нуклеотидів і переводять її відповідно до генетичного коду в амінокислотну послідовність. Фактично, первинна структура – це лінійне зображення білкової молекули. Знання первинної структури використовується для передбачення й встановлення вторинної та третинної структури білка. Одночасне використання амінокислотної послідовності й кристалографічних карт електронної густини дозволяє визначити координати всіх атомів у білку за виключенням протонів.
У поліпептидному ланцюгу пептидна група є плоскою та жорсткою, і поліпептидний ланцюг уявляється як послідовність пептидних груп (однотипних площин), які з'єднані між собою поодинокими зв'язками N – C і C – C. Обертання навколо цих зв'язків не є повністю довільним через стеричні обмеження. Кути обертання навколо зв'язків N – C і C - C позначають як і відповідно (рис. 4.1). Г. Рамачандран провів комп'ютерні розрахунки конформаційних станів поліпептидного ланцюга й визначив можливі значення і (графік Рамачандрана чи конформаційна карта). На конформаційній карті значення і у білках займають конкретні ділянки, що свідчить про суттєві обмеження можливих конформацій поліпептидного ланцюга. Конформації білкових молекул зумовлені слабими взаємодіями між пептидними групами й боковими групами амінокислотних залишків. (рис. 4.1).
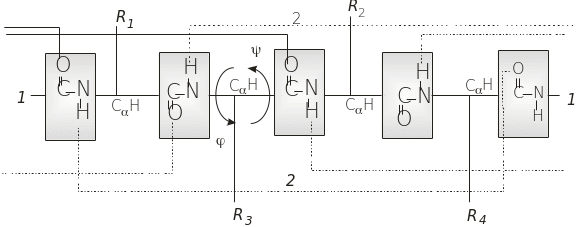
Рис. 4.1. Структурна організація білкової молекули:
Первинна структура (1 – 1) – послідовність амінокислотних залишків; і – торсійні кути; довжина зв'язків: C – N – 0,132 нм; N C 0,147 нм; C C – 0,153 нм; (2 – 2) – водневі зв’язки між пептидними групами в -спіралі; R-бокові групи амінокислотних залишків
Вторинна структура білка – це локальне упорядкування поліпептидного ланцюга через утворення водневих зв'язків між пептидними групами. Енергетично й стерично вигідною вторинною структурою в білках є права -спіраль (рис. 4.2), яку вперше було постульовано Л. Полінгом і Р. Корі (1951). В основу спіралі покладено три принципи: принцип копланарності, який полягає в тому, що чотири атоми пептидної групи – CONH за рахунок спряження розташовані в одній площині; принцип співвалентності – кожний амінокислотний залишок по відношенню до сусідів і до спіралі перебуває в ідентичному (еквівалентному) положенні; водневі зв’язки мають розташовуватися на прямій лінії, відхилення не повинні перевищувати 200 C. Найбільш важливі характеристики -спіралі: 3,6 амінокислотних залишків на один виток спіралі; виток спіралі, d = 0,54 нм; зміщення на один амінокислотний залишок уздовж осі спіралі, d = 0,15 нм; радіус спіралі, r = 0,23 нм; водневі зв’язки (паралельні осі -спіралі) утворюються між кожною першою та п’ятою, другою і шостою і так далі пептидними групами; торсійні кути для α-спіралі: ψ = –47о і = – 57о. Як видно з поперечного перерізу α-спіралі (рис. 4.2), за кожен оберт спіралі відбувається зміщення вправо на 40о.
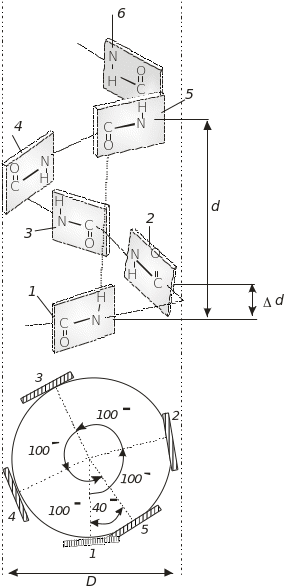
Рис.4.2. Права -спіраль: а – повздовжнє зображення спіралі; 1–6 – пептидні групи; 7 – водневі зв’язки; d – виток спіралі; d – відстань між пептидними групами вздовж осі спіралі; б – поперечний переріз спіралі; D – діаметр спіралі
Через таке зміщення тільки через 10 обертів α-спіралі пептидна група 1 буде точно збігатися із пептидною групою 36. Можливі інші спіральні конформації поліпептидного ланцюга: 310- і π-спіраль. У білках 310-спіраль зустрічається рідко і на достатньо коротких ділянках поліпептидного ланцюга. Її назва 310 – це три амінокислотні залишки, які припадають на виток спіралі, 10 – кількість атомів між одним водневим зв’язком. Ця спіраль є більш скрученою і її радіус (r = 0,19 нм) є меншим за радіус α-спіралі.
Тільки теоретично можлива π-спіраль. У білках її не було виявлено експериментальними методами. Ця спіраль є менш скрученою та має радіус (r = 0,28 нм) більший, ніж в -спіралі. У π-спіралі на виток спіралі припадає 4,4 амінокислотні залишки.
Вторинними структурами в білках є паралельні й антипаралельні -складчасті листи (або - структура) (рис. 4.3).

Рис. 4.3. Антипаралельний -складчастий лист: l і t – довжина й ширина листа, відповідно; в – водневі зв'язки; d = 0,68 нм (відстань між вигинами)
На конформаційній карті Ромачандрана для -листа з антипаралельними ланцюгами = -139о і = +135о, для -листа з паралельними ланцюгами = -119о і = +113о. Більшість -листів мають не більше шести поліпептидних ланцюгів, які стабілізовані водневими зв’язками, і по шість амінокислотних залишків у кожному ланцюгу. Розмір такого листа: ширина t = 2,5 нм і довжина l = 2,0 нм. Більшість складчастих -листів мають скручену форму. Скручування здійснюється перпендикулярно до витягнутих ланцюгів.
Надвторинна структура. Наступним рівнем організації білкових молекул є надвторинні структури. Прикладом таких структур є суперспіральні структури, в яких дві -спіралі (у тропоміозині, легкому мероміозині, параміозині) чи три -спіралі (у фібриногені), скручені одна відносно одної (рис. 4.4, а).

Рис. 4.4. Надвторинні білкові структури:
а – суперспіраль: d – крок суперспіралі; 1 – -спіраль; б – поперечний переріз суперспіралі; гептапептид амінокислотних залишків 1–7 (гідрофобні залишки 1, 4 і 1, 4); в – з’єднання паралельних -листів (-структура); г – поперемінне з’єднання -листів і -спіралей (-структура)
Крок суперспіралі в легкому мероміозині d =18,6 нм. Завдяки такій структурній організації замість меріодинального рентгенівського рефлексу 0,54 нм, який характерний для -спіралі, реєструється рефлекс 0,51 нм, характерний для суперспіралей. У тропоміозині, для якого повністю встановлено послідовність амінокислотних залишків, суперспіраль стабілізується гідрофобними взаємодіями між окремими -спіралями. У суперспіральних структурах виявлено повторні структурні одиниці – гептапептиди. Кілька амінокислотних залишків у такому гептапептиді є гідрофобними. Отже, в суперспіральній структурі тропоміозину поверхні двох -спіральних циліндрів розміщуються таким чином, що гідрофобні залишки однієї -спіралі збігаються з гідрофобними залишками іншої (рис. 4.4, б). Розміщуючись всередині суперспіральної структури, неполярні залишки не мають термодинамічно невигідних контактів з полярними молекулами води й через гідрофобні взаємодії стабілізують суперспіральну структуру білків. Можливі інші типи надвторинних структур білків. Це з’єднання -складчастих листів – -структура (рис. 4.4, в) чи комбінації -листів з -спіралями – -структура (рис. 4.4, г).
За
амінокислотною послідовністю в
поліпептидному ланцюгу здійснюється
теоретичне передбачення вторинної
структури білка, яке базується на
припущенні, що конформації поліпептидних
ланцюгів визначаються локальними,
ближніми взаємодіями. У методі П. Чоу
і Г. Фасмана (1974) ця процедура є такою.
Проаналізувавши дані рентгеноструктурного
аналізу багатьох білків, автори
запропонували такий параметр, як
зустрічність
стрівальність,
зустрічальність
f
амінокислотних
залишків у тій чи іншій конформацій: f
=![]() ,
де
,
де
![]() – кількість
залишків даного типу в -спіралі,
чи в -структурі,
чи в неупорядкованому клубку; n
–
загальна кількість залишків даного
типу у всіх проаналізованих білках. Для
передбачення вторинної структури
використовується конформаційний
параметр Р.
Для -спіралі
Р
=
– кількість
залишків даного типу в -спіралі,
чи в -структурі,
чи в неупорядкованому клубку; n
–
загальна кількість залишків даного
типу у всіх проаналізованих білках. Для
передбачення вторинної структури
використовується конформаційний
параметр Р.
Для -спіралі
Р
=
![]() ,
де f
– зустрічність даної амінокислоти в
-спіралі;
,
де f
– зустрічність даної амінокислоти в
-спіралі;![]() – середнє значення, тобто сума f
для
всіх амінокислот, поділена на 20 (кількість
різних амінокислот у білку). Аналогічно
знайдено конформаційні параметри для
-структури
листа
–
Р
і клубка – Рк.
Якщо Р
=
1, то такий амінокислотний залишок може
зустрічатися і в -спіралі,
і в -структурі
й у клубку,
але якщо Р
1,
тоді дуже велика вірогідність, що такий
залишок буде утворювати -спіраль,
якщо ж Р
1
– амінокислотний залишок буде рідко
зустрічатися в -спіралі.
У табл. 4.1 наведено значення f
i P,
які отримано в результаті аналізу 25
білків.
– середнє значення, тобто сума f
для
всіх амінокислот, поділена на 20 (кількість
різних амінокислот у білку). Аналогічно
знайдено конформаційні параметри для
-структури
листа
–
Р
і клубка – Рк.
Якщо Р
=
1, то такий амінокислотний залишок може
зустрічатися і в -спіралі,
і в -структурі
й у клубку,
але якщо Р
1,
тоді дуже велика вірогідність, що такий
залишок буде утворювати -спіраль,
якщо ж Р
1
– амінокислотний залишок буде рідко
зустрічатися в -спіралі.
У табл. 4.1 наведено значення f
i P,
які отримано в результаті аналізу 25
білків.
Таблиця 4.1. Зустрічність f і конформаційний параметр Р різних амінокислотних залишків в -спіралях, -листах і нерегулярних ділянках клубок
Амінокислоти та їхні позначення |
-спіраль |
-лист |
Нерегулярна ділянка (клубок) |
|||
f |
P |
f |
P |
f |
P |
|
Аланін, Ala, A |
0,522 |
1,45 |
0,167 |
0,97 |
0,311 |
0,66 |
Аргінін, Arg, R |
0,282 |
0,154 |
0,564 |
|||
|
|
|
|
|
|
|
Аспарагін, Asn, N |
0,263 |
0,73 |
0,113 |
0,65 |
0,624 |
1,33
|
Аспарагінова кислота, Asp, D |
0,351 |
0,98 |
0,137 |
0,80 |
0,514 |
1,09 |
Цистеїн, Cys, C |
0,278 |
0,77 |
0,222 |
1,30 |
0,500 |
1,07 |
Глутамін, Gln, Q |
0,421 |
1,17 |
0,211 |
1,23 |
0,368 |
0,79 |
Глутамінова кислота, Glu, E |
0,549 |
1,53 |
0,044 |
0,26 |
0,407 |
0,87 |
Гліцин, Gly, G |
0,190 |
0,53 |
0,138 |
0,81 |
0,668 |
1,42
|
Гістидин, His, H |
0,446 |
1,24 |
0,122 |
0,71 |
0,432 |
0,92 |
Ізолейцин, Ile, I |
0,358 |
1,00 |
0,274 |
1,60 |
0,368 |
0,78 |
Лейцин, Leu, L |
0,480 |
1,34 |
0,209 |
1,22 |
0,311 |
0,66 |
Лізин, Lys, K |
0,383 |
1,07 |
0,126 |
0,74 |
0,491 |
1,05 |
Метіонін, Met, M |
0,429 |
1,20 |
0,286 |
1,67 |
0,286 |
0,61 |
Фенілаланін, Phe, F |
0,402 |
1,12 |
0,219 |
1,28 |
0,378 |
0,81
|
Пролін, Pro, P |
0,212 |
0,59 |
0,106 |
0,62 |
0,682 |
1,45 |
Серин, Ser, S |
0,282 |
0,79 |
0,124 |
0,72 |
0,594 |
1,27 |
Треонін, Thr, T |
0,295 |
0,82 |
0,205 |
1,20 |
0,494 |
1,05 |
Триптофан, Trp, W |
0,409 |
1,14 |
0,203 |
1,19 |
0,386 |
0,82
|
Тирозин, Tyr, Y |
0,220 |
0,61 |
0,220 |
1,29 |
0,500 |
1,19 |
Валін, Val, V |
0,409 |
1,14 |
0,282 |
1,65 |
0,309 |
0,66 |
Передбачення вторинної структури здійснюється за такою процедурою. Розглядаючи відому амінокислотну послідовність білка, кожному амінокислотному залишку приписують свій конформаційний параметр Р, використовуючи дані табл. 4.1. Коли в поліпептиді розміщені такі амінокислоти, як глутамінова кислота (Р = 1,53), аланін (1,45), лейцин (1,34), то така ділянка поліпептидного ланцюга буде мати конформацію -спіралі, а коли метіонін (Р = 1,67), валін (1,65), ізолейцин (1,60), тоді завжди буде -структура. Наявність неупорядкованих ділянок білка завжди зумовлено присутністю проліну (Рк = 1,45) і гліцину (1,42).
