
- •План изучения дисциплины «Биохимия и основы биорегуляции организмов» (VI cеместр, III курс)
- •Итого: 14 часов Практические и семинарские занятия
- •Введение
- •Тема 1. Аминокислоты. Белки Занятие 1. Лабораторно-практическое занятие «Качественные реакции на белки. Реакции осаждения белков»
- •Методические рекомендации к занятию
- •План занятия
- •Вопросы и задания для самоконтроля
- •Занятие 2. Лабораторно-практическое занятие «Формольный метод определения аминного азота»
- •Методические рекомендации к занятию
- •План занятия
- •Вопросы и задания для самоконтроля
- •Тема 2. Ферменты Занятие 1. Лабораторно-практическое занятие «Белки – ферменты. Физико-химические свойства ферментов»
- •Методические рекомендации к занятию
- •План занятия
- •Вопросы и задания для самоконтроля
- •Занятие 2. Лабораторно-практическое занятие «Определение активности каталазы (по а.Н. Баху и а.И. Опарину)
- •Методические рекомендации к занятию
- •План занятия
- •Вопросы и задания для самоконтроля
- •Занятие 3. Семинар «Ферменты – биокатализаторы. Классификация ферментов»
- •Тема 3. Углеводы Занятие 1. Лабораторно-практическое занятие «Методы биохимических исследований. Рефрактометрия»
- •Методические рекомендации к занятию
- •План занятия
- •Вопросы и задания для самоконтроля
- •Тема 4. Витамины Занятие 1. Семинар «Витамины»
- •Методические рекомендации к занятию
- •План занятия
- •Вопросы и задания для самоконтроля
- •Занятие 2. Лабораторно-практическое занятие «Количественное определение витамина с»
- •Методические рекомендации к занятию
- •План занятия
- •Вопросы и задания для самоконтроля
- •Тема 5. Нуклеиновые кислоты
- •Методические рекомендации к занятию
- •Терминологический словарь к семинару
- •План занятия
- •Вопросы и задания для самоконтроля
- •Рекомендуемая литература
- •Примерная тематика курсовых работ
- •Методические рекомендации к к лабораторно-практическим и семинарским занятиям по дисциплине «Биохимия и основы биорегуляции организмов (ч.1.)»
- •607220, Г. Арзамас, Нижегородская обл., ул. К.Маркса, 36
- •607220, Г. Арзамас, Нижегородская обл., ул. К.Маркса, 36
Тема 2. Ферменты Занятие 1. Лабораторно-практическое занятие «Белки – ферменты. Физико-химические свойства ферментов»
3 часа
Цель работы: ознакомиться с каталитической функцией ферментов, изучить основные физико-химические свойства ферментов на примере амилазы.
Оборудование: штатив с пробирками, водяная баня, термометр, стеклянные палочки, предметные стекла, секундомер, термостат.
Реактивы: 0,5-1% раствор крахмала, слюна разбавленная в 5 раз, раствор Люголя, термометр, предметные стекла, стеклянные палочки, 1/15М дигидрофосфат калия, 1/15М гидрофосфат натрия, фермент амилаза, 1% раствор сахарозы, 10% раствор гидроксида натрия, 1% раствор сульфата меди, дистиллированная вода, 1% раствор хлорида натрия, йод в иодиде калия.
Основная литература:
Филлипович С.Б., Ковалевская Н.И., Севастьянова Г.А. Биологическая химия: учебное пособие для вузов. М.: Академия, 2005. – 254 с.
Проскурина И.К. Биохимия: Учебное пособие для вузов. – М.: ВЛАДОС-Пресс, 2003. – 235с.
Филлипович С.Ю., Коничев А.С., Севастьянова Г.А., Кутузова Н.М. Биохимические основы жизнедеятельности человека: учебное пособие для вузов. – М.: ВЛАДОС, 2005 г. – 404с.
Опарина С.А. Биохимия и основы биорегуляции организмов: Учебно-методическое пособие. - Арзамас: АГПИ, 2009. – 144 с.
Дополнительная литература:
1. Основы биохимии: Учебник для студ. биол. спец. универ. /А.А. Анисимов, А.Н.Леонтьева, И.Ф. Александрова и др. – М.: Высшая школа, 1986. – С. 133-171.
2. Грин Н. Биология в 3-х томах / Н. Грин, У. Стаут, Д. Тейлор. – М.: Мир, 1993.- С.195-210.
3. Ленинджер А. Л. Основы биохимии в 3-х томах. – М.: Мир, 1985.- Т1- С.226-269.
Марри Р. Биохимия человека в 2-х томах. Мари Р., Греннер Д. и др. – М.: Мир, 1993. - Т1 – С.63-95.
5. Березов Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф Коровкин. – М.: Москва, "Медицина", 2007 г.- С.75-110.
Методические рекомендации к занятию
При подготовке к занятию студенты должны
знать:
- особенности строения, физико-химические свойства ферментов (на примере амилазы слюны);
- качественные реакции на моно- и полисахариды.
уметь:
- экспериментально выявлять влияние температуры, рН среды, активаторов и ингибиторов на свойства ферментов.
- записывать уравнения реакций, лежащих в основе работы, расставлять коэффициенты методом полуреакций в ОВР.
План занятия
ТЕОРЕТИЧЕСКИЙ ПРАКТИКУМ
1. Строение и свойства ферментов.
2. Классификация ферментов по строению.
3. Особенности строения и свойств фермента амилазы.
4.Уравнения реакций, лежащих в основе работы.
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Выполнение лабораторной работы «Физико-химические свойства ферментов» из [4], с.38-42.
Вопросы и задания для самоконтроля
На схеме изображён активный центр фермента:

Ответьте на следующие вопросы:
а) Назовите аминокислоты, радикалами которых входят в активный центр этого фермента.
б) Изобразите схематически структуру субстрата, который может быть комплементарен активному центру данного фермента. Укажите его функциональные группы.
в) Какие типы связей могут образовываться между радикалами аминокислот активного центра фермента и функциональными группами субстрата?
г) Чем обусловлена субстратная специфичность ферментов? (Выберите один наиболее правильный ответ).
1. Химическим соответствием активного центра фермента субстрату.
2. Наличием кофермента.
3. Набором определённых функциональных групп в активном центре фермента.
4. Комплементарностью активного центра фермента и субстрата.
5. Пространственным соответствием активного центра фермента субстрату.
Изобразите в виде графика зависимость скорости реакции от концентрации субстрата.
а) Отметьте на графиках Vmax и Km. Дайте определение этим величинам. Как характеризует фермент Km?
б) Используя данные о зависимости скорости реакции (V) от концентрации субстрата (S), представленные в таблице, оцените приблизительно значения Vmax и Km.
Концентрация субстрата (S) мкмоль/л |
Скорость реакции (V) мкмоль/мин |
0.2 0.4 0.8 1.6 |
15 21 28 30 |
Выберите и укажите правильный порядок событий, происходящих в процессе ферментативного катализ, соединив указанные ниже номера стрелками (например, 1→ 3 → 2… и т.д.):
Возникает индуцированное соответствие между активным центром фермента и субстрата
Субстрат приближается к активному центру фермента.
Происходит образование продуктов реакции.
Выход продуктов из области активного центра фермента.
Происходит увеличение прочности связей в субстрате.
Происходит дестабилизация связей в субстрате.
Рассмотрите схему ферментативной реакции
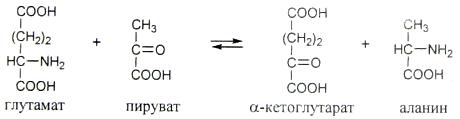
а) Назовите класс и подкласс фермента, катализирующего данную реакцию.
б) Назовите кофермент, необходимый для протекания данной реакции.
в) У грудных детей описаны дерматиты, поражения нервной системы, связанные с недостатком в искусственной пище витамина, входящего в состав данного фермента. Объясните, почему, несмотря на низкую потребность организма в витаминах (суточная потребность в этом витамине составляет ~ 2 мг), при их отсутствии (авитаминозе) или даже недостатке (гиповитаминозе) могут возникать очень серьёзные последствия?
г) Как изменится активность фермента при изменении pH от 7.4 до 5.0? Объясните причину этого явления, поставив в соответствующем порядке события, приводящие к изменению активности фермента:
1. Происходит изменение активного центра фермента.
2. Происходит гидролиз пептидных связей.
3.Происходит изменение конформации фермента.
4. Происходит изменения ионизации функциональных групп фермента и субстрата.
5. Происходит нарушение комплиментарности активного центра фермента и субстрата.
5. В состав сукцинатдегидрогеназы сердца входят 8 атомов железа при содержании последнего 0,22%. Рассчитайте молекулярную массу фермента.
6. Активный центр фермента обычно представляет собой "карман" на поверхности фермента, выстланный боковыми цепями аминокислот, необходимыми для связывания субстрата и катализа его химического превращения. Молекула карбоксипептидазы, последовательно отщепляющей С-концевые аминокислотные остатки от субстратов (пептидов), состоит из одной полипептидной цепи (307 аминокислотных остатков). Три главные каталитические группы в активном центре - это аргинин 145, тирозин 248 и глутаминовая кислота 270 (номер указывает положение аминокислоты в цепи).
а) Если бы карбоксипептидаза представляла собой идеальную α-спираль, то на каком расстоянии (в нм) друг от друга находились бы аргинин 145 и тирозин 248, аргинин 145 и глутаминовая кислота 270?
б) Объясните, каким образом эти три аминокислоты, расположенные так далеко друг от друга в полипептидной цепи, могут катализировать реакцию, участники которой занимают пространство размером в несколько десятых долей нанометра.
в) Если в процессе гидролиза участвуют только эти три каталитические группы, для чего ферменту необходимо иметь так много аминокислотных остатков?
7. Молекула папаина (растительная протеиназа) содержит 211 аминокислотных остатков. Псевдокристаллическая часть молекулы папаина представлена четырьмя короткими α-спиралями, каждая из которых содержит 10 аминокислотных остатков, и фрагмента полипептидной цепи из 9 аминокислотных остатков, находящегося в β-конформации. Определите количество аминокислотных остатков, составляющих неупорядоченную часть полипептидной цепи в молекуле папаина, и рассчитайте степень спирализации ее полипептидной цепи.
8. Рассмотрите схему ферментативной реакции:
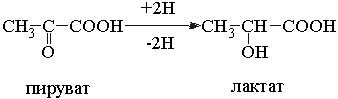
а) Назовите фермент, катализирующий данную реакцию, и приведите его классификацию
б) Рассчитайте удельную активность фермента, если за 30 с 1 мг фермента при оптимальных условиях инкубации (рН 7,2; 37 0С) превращает 50 мкмоль пирувата.
