
- •Дисперсные системы
- •1. Классификация поверхностных явлений и дисперсных систем
- •1.1. Классификация поверхностных явлений
- •1.2. Классификация дисперсных систем
- •2. Термодинамика
- •2.1. Поверхностная энергия (поверхностное натяжение)
- •2.2. Влияние температуры на поверхностное натяжение
- •3. Адсорбция и поверхностная активность
- •3.1. Основные понятия
- •Расстояние от поверхности
- •3.2. Термодинамика адсорбционных процессов
- •3.3. Уравнения изотерм адсорбции
- •Давление адсорбата
- •Размеры пор и удельная поверхность адсорбентов зависят от технологии их изготовления и различны для разных марок адсорбентов (табл. 3.2).
- •4. Смачивание поверхности
- •4.1. Смачивание поверхности и растекание жидкостей
- •4.2. Капиллярные явления
- •4.3. Адгезия и когезия
- •5. Поверхностно-активные вещества
- •5.1. Классификация поверхностно-активных веществ
- •5.2. Использование поверхностно-активных веществ
- •5.3. Поверхностно-активные вещества и
- •Изменение объёма пены во времени
- •Вопросы для самопроверки
- •6. Строение двойного
- •6.1. Строение двойного электрического слоя
- •6.2. Электрокинетические явления
- •7. Получение, устойчивость и
- •7.1. Методы получения и стабилизации
- •7.2. Строение мицелл
- •7.3. Кинетическая и агрегативная устойчивость
- •7.4. Оптические свойства дисперсных систем
- •7.5. Области использования дисперсных систем
- •Список рекомендуемой литературы
- •Содержание
- •Поверхностные явления и
- •392000, Тамбов, Советская, 106, к. 14
- •Поверхностные явления
- •Дисперсные системы
3. Адсорбция и поверхностная активность
3.1. Основные понятия
Адсорбцией называют процесс образования слоя с поверхностным избытком или недостатком вещества на границе раздела фаз за счёт свободной энергии поверхности адсорбента.
К
сг.
cо.
Рис. 3.1. Адсорбция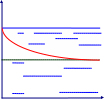 онцентрация
вещества
онцентрация
веществаРасстояние от поверхности
Связь между поверхностным избытком (Г) и производной поверхностного натяжения по концентрации растворённого вещества (d / dc) описывается уравнением Гиббса:
– Г = с R –1 T –1 (d / dc),
где с — концентрация раствора, моль/л; R — универсальная газовая постоянная, Дж/(моль К); T — температура, К.
Встречается положительная и отрицательная адсорбция.
Адсорбцию называют положительной, если концентрация адсорбирующихся молекул или ионов у поверхности раздела фаз выше, чем в объёме жидкости или газа, при этом (d / dc) < 0. Например, переход гидрофобных органических молекул из объёма раствора на поверхность адсорбента. Такие вещества называют поверхностно-активными.
Адсорбцию называют отрицательной, если концентрация адсорбата убывает по мере приближения к поверхности раздела фаз, при этом (d / dc ) > 0. Отрицательная адсорбция вызывается сольватацией и втягиванием сильно сольватированных молекул в объём раствора неэлектролита (более 1 М ), а в случае раствора электролита — отталкиванием ионов от одноимённо заряженной поверхности металла (в растворах с любой концентрацией).
Различают адсорбцию физическую и активированную и хемосорбцию.
Физическая адсорбция — это процесс адсорбции молекул, ионов и т.д. без изменения их строения. Выделение энергии в этом процессе незначительно (8 … 25 кДж/моль). Физическая адсорбция чаще всего наблюдается при низких температурах.
Активированная адсорбция — это процесс взаимодействия адсорбата с поверхностью адсорбента, сопровождающийся выделением энергии (25 … 80 кДж/моль) и изменением строения адсорбата без образования новых химических веществ.
Хемосорбция — это процесс адсорбции молекул, ионов, радикалов и т.д., при котором на поверхности раздела фаз протекает реакция адсорбента с адсорбатом с образованием новых химических соединений и выделением значительного количества энергии ( 80 кДж/моль). Причём продукты десорбции отличаются от исходного вещества. Этот процесс наблюдается в топохимических реакциях.
Особенность топохимической реакции состоит в том, что поверхность раздела фаз образуется в результате самой реакции и изменяется во времени, а потому протекает нестационарно. Топохимические реакции имеют индукционный период, в течение которого реагируют наиболее реакционноспособные молекулы, ионы, радикалы и т.д. на поверхности твёрдого адсорбента в области дефектов (например, дислокаций). Затем появляются зародыши (ядра продукта) и возникает новая поверхность раздела фаз за счёт слияния разрастающихся ядер продукта топохимической реакции. Площадь образующейся поверхности раздела фаз и скорость топохимической реакции изменяются во времени, достигают максимума и затем уменьшаются.
В топохимической реакции могут принимать участие твёрдые, газообразные и жидкие вещества.
Следует также различать понятия адсорбции Гi (поверхностный избыток) и поверхностной концентрации А i (т.е. количество адсорбата непосредственно связанного с единицей поверхности адсорбента). Обе величины имеют размерность моль/м2, но поверхностная концентрация — величина всегда положительная, а поверхностный избыток может быть как положительным, так и отрицательным (мы уже упоминали об этом). Поэтому для расчёта поверхностной концентрации адсорбата по опытным значениям поверхностного избытка необходимо вводить модельные представления о характере распределения концентрации молекул адсорбата в зависимости от расстояния до поверхности адсорбента. Часто принимается, что изменение концентрации адсорбата подчиняется Больцмановскому распределению и происходит ступенчато: так, что весь поверхностный избыток локализован в пределах одного молекулярного слоя. В этом случае величина адсорбции равна поверхностной концентрации.
Адсорбированные молекулы могут покидать поверхность адсорбента. Этот процесс называют десорбцией. Через некоторое время устанавливается динамическое равновесие между скоростями адсорбции и десорбции — так называемое адсорбционное равновесие.
Итак, адсорбция характеризует изменение состава поверхностного слоя по сравнению с идеальной системой, в которой концентрация всех компонентов постоянна вплоть до самой границы раздела фаз.
