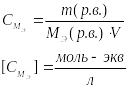- •5.1. Комплексные соединения без внешней сферы
- •5.2. Отщепление ионов внешней сферы
- •5.3. Обратимая диссоциация комплексов
- •5.4. Ступенчатая и полная константы образования
- •5.5. Константы образования и прочность комплексов
- •5.6. Константы нестойкости
- •6.3. Характер изменения свойств оснований в зависимости от положения металла в периодической системе и его степени окисления
- •6.4. Зависимость силы кислот от положения элемента в периодической системе и его степени окисления
1 вопрос. Атомно-молекулярная теория. Атом, молекула. Химический элемент. Простое и сложное вещество. Аллотропия. Атомно-молекулярные представления в химии впервые предложены великим русским учёным М. В. Ломоносовым. Согласно атомно-молекулярной теории, молекулой называется мельчайшая частица простого или сложного вещества, обладающая весовым составом и химическими свойствами данного вещества и способная существовать самостоятельно. Основные законы атомно-молекулярной теории:1.Закон сохранения массы - масса исходных веществ, вступивших в реакцию, равна массе получившихся веществ.2.Закон эквивалентов. Эквивалент-такое количество, которое в реакциях ионного обмена эквивалентно одному протону, гидрооксиду аниону или любому другому однозарядному иону, а в реакциях окисления и восстановления одному электрону. Моль эквивалент – такое количество вещества, которое включает количество эквивалентов, равное числу Авагадро. 3.Закон постоянства состава. Любое химическое индивидуальное соединение имеет один и тот же количественный состав независимо от способа получения.4.Закон Авагадро. В равных объёмах разных газов при одной и той же температуре и давлении содержится одно и тоже количество молекул. Основные положения атомно-молекулярной теории состоят в следующем: 1.Все вещества состоят из молекул. Молекула – это наименьшая частица вещества, сохраняющая свойства того вещества.2.Между молекулами имеются промежутки у газов – самые большие, у твёрдых веществ – самые маленькие. 3.Молекулы двигаются беспорядочно и неприрывно.4.Молекулы одного вещества имеют одинаковый состав и свойства, молекулы разных веществ отличаются друг от друга по составу и ствойствам.5.Молекулы состоят из атомов. Атом- электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.6.Химический элемент – простое вещество, которое не может быть разложено на другое вещество и не может быть превращено в другое простое вещество. 7.Атомы одного элемента образую молекулы простого вещества; атомы разных элементов образуют молекулы сложного вещества. Сложные неорганические вещества по составу подразделяются на двухэлементные (бинарные) и многоэлементные соединения. Аллотро́пия — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам — так называемых аллотропических (аллотропных) модификаций или форм. Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
|
4 вопрос. Химические газовые законы . Закон Авогадро .Молярный объем. Закон Бойля-Мариотта: при постоянной температуре объём данной порции газа обратно пропорционален его давлению. (pV=const) Закон Гей-Люссака: при постоянном давлении объём данной порции газа прямо пропорционален его абсолютной температуре. (V1/ T1 = V2/T2 = const) Объединённый газовый закон: произведение величины давления данной порции газа на величину его объёма, отнесённое к значению абсолютной температуры, есть величина постоянная. (P0V0/T0=P1V1/T1=const) Закон парциальных давлений газов: общее давление смеси газов, не вступающих в химическое взаимодействие, равно сумме парциальных давлений каждого из них. Закон Авогадро: В равных объёмах различных газов при одинаковых внешних условиях (давлении и температуре) содержится одинаковое число молекул. Молярный объём: при н. у. давлении: 101,325 кПа, температуре 0 или 273 К. (Vm=22,4)
5 вопрос. Основные стехиометрические законы. Закон эквивалентов. Закон постоянства состава Нестехиометрические соединения. Основные законы: 1.Закон сохранения массы - масса исходных веществ, вступивших в реакцию, равна массе получившихся веществ.2.Закон эквивалентов. (Рихтер) Эквивалент-такое количество, которое в реакциях ионного обмена эквивалентно одному протону, гидрооксиду аниону или любому другому однозарядному иону, а в реакциях окисления и восстановления одному электрону. Моль эквивалент – такое количество вещества, которое включает количество эквивалентов, равное числу Авагадро. 3.Закон постоянства состава. (Пруст)Любое химическое индивидуальное соединение имеет один и тот же количественный состав независимо от способа получения.4.Закон Авагадро. В равных объёмах разных газов при одной и той же температуре и давлении содержится одно и тоже количество молекул.5. Закон кратных отношений (Дальтон): Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.6. Закон простых объемных отношений (Гей-Люссак):при равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов, как небольшие целые числа.
|
6 вопрос. Строение электронных оболочек атома. Волновая теория строения атома. Понятие об электронном облаке. Вокруг положительного ядра движутся электроны, которые образуют электронные оболочки атома. Электроны различаются своей энергией, чем дальше от ядра расположены электроны, тем большим запасом энергии они обладают. Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома. Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N-число электронов на слое, n-номер слоя. Произведя простые расчеты, выясним, что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это необходимо учитывать при распределении электронов по энергетическим слоям. После заполнения второго слоя до восьми электронов появляется третий слой. Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов. Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой. Электронное облако — это наглядная модель, отражающая распределение функции плотности вероятности обнаружения электрона в атоме или молекуле. В качестве наглядной модели состояния электрона в атоме в химии принят образ облака, плотность соответствующих участков которого пропорциональна вероятности обнаружить там электрон. Электронное облако рисуется наиболее плотным (там, где наибольшее число точек) в областях наиболее вероятного обнаружения электрона.
7 вопрос. Квантовые числа как характеристика состояния электрона в атоме. Физический смысл квантовых чисел. Энергетический уровень, подуровень. Атомная орбиталь. Форма и ориентация электронных облаков. Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений. Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения. s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μl = 0. p-Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. Семь f-орбиталей, соответствующих l = 3 (n ≥ 4).Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз. Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон. Электронное облако не имеет резко очерченных границ в пространстве, поэтому представления о размерах и форме электронного облака требуют специального пояснения. Электронное облако атома водорода. В этом облаке можно провести поверхности, на которых электронная плотность будет иметь одинаковое значение. В случае атома водорода это сферические поверхности, внутри которых заключена большая или меньшая часть электронного облака. Если проведённая поверхность охватывает 90 % заряда и массы электрона, её называют граничной поверхностью. Размер и форму граничной поверхности отождествляют с размером и формой электронного облака.
|
8 вопрос. Принцип Паули и емкость электронных оболочек. Правило Хунда. Порядок заполнения атомных орбиталей. Правила Клечковского. Строение электронных оболочек атомов химических элементов. Принцип Паули – не может быть двух и более электронов в атоме, состав которых характеризуется четырьмя одинаковыми квантовыми числами. Орбиталь характеризуется тремя квантовыми числами. Заполнение электронов атомов в пределах подуровня осуществляется так, чтобы суммарный спин электронов был максимальный. Правило Хунда- определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спиновогоквантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю. s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μl = 0. p-Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. Семь f-орбиталей, соответствующих l = 3 (n ≥ 4).Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз. Правило Клечковского - 1.Заполнение подуровня. Сумма главного и орбитального квантового числа, которое наименьшее. 2. Если сумма главного и орбитального квантого числа одинакова, то начинает заполняться подуровень, тот у которого меньше квантовое число. Вокруг положительного ядра движутся электроны, которые образуют электронные оболочки атома. Электроны различаются своей энергией, чем дальше от ядра расположены электроны, тем большим запасом энергии они обладают. Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома. Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N-число электронов на слое, n-номер слоя. Произведя простые расчеты, выясним, что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это необходимо учитывать при распределении электронов по энергетическим слоям. После заполнения второго слоя до восьми электронов появляется третий слой. Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов. Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой.
|
9 вопрос. Периодический закон и периодическая система элементов. Заполнение электронами атомных орбиталей и формирование периодов и групп. Главные и побочные подгруппы. Электронные аналоги, изоэлектронные частицы. Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно. Периодический закон в формулировке Д.И. Менделеева: Свойство элемента, а также форма и свойства образования или соединения находятся в природе независимо от величины заряда ядр их атомов. На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов. Подгруппы, в которых расположены s- и p-элементы, называют ГЛАВНЫМИ, а подгруппы с d-элементами - ПОБОЧНЫМИ ПОДГРУППАМИ. Вокруг положительного ядра движутся электроны, которые образуют электронные оболочки атома. Электроны различаются своей энергией, чем дальше от ядра расположены электроны, тем большим запасом энергии они обладают. Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома. Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N-число электронов на слое, n-номер слоя. Произведя простые расчеты, выясним, что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это необходимо учитывать при распределении электронов по энергетическим слоям. После заполнения второго слоя до восьми электронов появляется третий слой. Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов. Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой. Электронные аналоги – элементарные структуры внешних уровней. Изоэлектронные частицы – это частицы, имеющие одинаковую электронную оболочку. Радиус изоэлектронных ионов уменьшается с увеличением заряда ядра, т.к. заряд ядра увеличивается.
|
10 вопрос. Периодичность свойств атомов. Изменение радиусов атомов по периодам и группам. Энергия ионизации атомов. Изменение энергии ионизации по периодам и группам. Сродство к электрону. Электроотрицательность элементов, изменение величины ЭО в периодической системе.Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность. Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов. В расчетах пользуются так называемыми эффективными, или кажущимися, радиусами, т.е. радиусами шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных. Радиус атома — важная его характеристика. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электроны притягиваются к ядру сильнее. В периоде атомный радиус в общем уменьшается с увеличением порядкового номера элемента. Это объясняется ростом силы притяжения электронов с ростом заряда ядра. В подгруппах с увеличением порядкового номера элемента атомный радиус возрастает, так как в результате прибавления дополнительного электронного слоя увеличивается объем атома, а значит, и его радиус. Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Ее обычно выражают в электронвольтах (эВ). При отрыве электрона образуется соответствующий катион. Энергия ионизации для элементов одного периода увеличивается с возрастанием заряда ядра. В подгруппе она уменьшается с ростом порядкового номера элемента вследствие увеличения рас-стояния электрона от ядра. Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшую энергию ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных газов связана с их высокими значениями энергии ионизации. Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергию ионизации, выражают в электронвольтах (эВ). Значения сродства к электрону известны не для всех элементов; измерить их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода. Определение электроотрицательности дал американский ученый Л. Полинг в 1932 г. Он предложил и первую шкалу электроотрицательности. Согласно Полингу, электроотрицательность есть способность атома в соединении притягивать к себе электроны. Имеются в виду валентные электроны, т.е. электроны, которые участвуют в образовании химической связи.
|
11 вопрос. Периодичность изменения химических свойств элементов, простых веществ и химических соединений в периодической системе. Изменение валентности по периодам и группам. Металлический и неметаллический характер элементов. Изменение химической активности металлов и неметаллов по периодам и группам. Изменение кислотно-основных свойств оксидов и гидроксидов. Периодичность - это повторяемость свойств химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элементов. Она связана, в первую очередь, с повторяемостью электронного строения атомов по мере увеличения порядкового номера (а, следовательно, заряда ядра и числа электронов в атоме). Химическая периодичность проявляется в аналогии химического поведения, однотипности химических реакций. При этом число валентных электронов, характерные степени окисления, формулы соединений могут быть разными. Периодически повторяются не только сходные черты, но и существенные различия химических свойств элементов по мере роста их порядкового номера. Периодичность изменения свойств элементов означает, таким образом, повторный возврат к тем же в основном признакам ( к металлическим свойствам щелочных, щелочноземельных, земельных и других металлов, к неметаллическим свойствам элементов групп фосфора, серы и хлора), которые уже встречались в предыдущем периоде и повторяются на известной ступени, через определенное число элементов в последующих периодах в строго закономерной последовательности. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические. Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях. Зависимость кислотно-основных свойств оксидов от положения элемента в периодической системе и его степени окисления . Слева направо по периоду у элементов происходит ослабление металлических свойств, и усиление неметаллических свойств, основные свойства оксидов ослабевают, а кислотные свойства оксидов возрастают. По главным подгруппам неметаллические свойства элементов ослабевают, а металлические усиливаются, поэтому: сверху вниз по главной подгруппе возрастают основанные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства. Химическая активность металлов (впрочем, и неметаллов тоже) очень сильно зависит от радиусов атомов - чем меньше радиус атома, тем активность больше. А радиусы атомов изменяются так: в периодах слева направо - уменьшаются, сверху вниз - увеличиваются. Элементы одной и той же подгруппы (в короткой форме таблицы) или группы (в длинной) имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами. s-Элементы имеют валентности, совпадающие с номером их группы (в любой форме таблицы). p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы в короткой форме Периодической таблицы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы в короткой форме таблицы (этот номер совпадает с числом электронов на внешней оболочке). d-Элементы обычно обнаруживают несколько разных валентностей, которые нельзя точно предсказать по номеру группы.Не только элементы, но и многие их соединения - оксиды, гидриды, соединения с галогенами - обнаруживают периодичность. Для каждой ГРУППЫ элементов можно записать формулы соединений, которые периодически "повторяются" (то есть могут быть записаны в виде обобщенной формулы).
|
|
12.Химическая связь. Основные типы химической связи. Полярность связи как функция разности электроотрицательностей химических элементов.Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.При образовании ковалентной химической связи важную роль в уменьшенииполной энергии играет обменное взаимодействие. Типы связи Одноэлектронная химическая связь, Металлическая связь, Ковалентная связь, Ионная связь ,Ван-дер-ваальсова связь, Водородная связь, Двухэлектронная трёхцентровая химическая связь Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещат ь к себе общие электронные пары.
13.Количественные характеристики химической связи: энергия связи, длина, валентный угол. Полярность связи и полярность молекулы в целом, дипольный момент молекулы. Химическая связь характеризуется рядом параметров. Чаще всего говорят об ее энергии и длине. Если молекула состоит из трех и более атомов, то к перечисленным параметрам добавляют еще один — валентные углы. ЭНЕРГИЕЙ СВЯЗИ называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находиться в основном (невозбужденном) состоянии и при 0оК. Эта величина определяет прочность связи. Чем больше энергия, затрачиваемая на разрыв связи, тем прочнее связь. Единица измерения энергии связи — кДж/моль..ДЛИНОЙ СВЯЗИ называют среднее расстояние между ядрами, отвечающее минимуму энергии системы. Кроме того, на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, межъядерные расстояния уменьшаются. Так, длина связи С—С равна 0,154 нм, С = С - 0,135 нм и С ≡ С - 0,121 нм. ВАЛЕНТНЫЕ УГЛЫ. Это углы между связями в молекуле. Их схематически можно представить как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые, проведенные через два ядра, называют линиями связи. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. Полярность молекул, как и полярность связи, характеризуется величиной дипольного момента. Суммарный дипольный момент молекулы зависит как от характера связи составляющих ее атомов, так и от расположения этих атомов в молекуле. Молекулы, дипольный момент которых равен нулю, а также вещества с такими молекулами называются неполярными. Полярность молекулы в целом равна векторной сумме моментов отдельных связей; существуют молекулы, дипольный момент которых равен нулю, хотя они и имеют полярные связи.
|
14. Квантовомеханическая трактовка механизма образования ковалентной связи в молекуле водорода. Ковалентная связь - это связь, возникающая между атомами за счет образования общих электронных пар. Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Ковалентная связь это когда два атома делятся электронами и держатся вместе.Однако, дважды лауреат Нобелевской премии Л.Полинг указывал, что "в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары"[2]. Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H2+.Молекулярный ион водорода H2+ содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H2+). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α0=0,53 Å и является центром симметрии молекулярного иона водорода H2+. 15 Ковалентная связь. Основные положения метода валентных связей .Спиновая теория валентности. Обменный и донорно-акцепторный механизм образования ковалентной связи. Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака. В 1927 г. Гайтлером и Лондоном был выполнен теоретический расчет энергии двух атомов водорода в зависимости от расстояния между ними. Оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины * взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах на энергетической кривой имеется минимум, т.е. образуется устойчивая система – молекула водорода Н2 ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону: ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора:
|
16 Валентность и степень окисления химических элементов в их соединениях. Валентностью элемента называется свойство (или способность) его атомов присоединять к себе (или замещать в молекулах сложных веществ) определенное число атомов другого элемента. В соединениях с ионной связью валентность равна числу электронов, отданных или присоединенных атомом при превращении его в ион. Валентность в ковалентных соединениях равна числу электронных пар, участвующих в образовании связи. Следовательно, валентность элемента определяется числом электронов, участвующих в образовании химических связей. Валентность некоторых элементов — величина постоянная. Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Численное выражение степени окисления называют окислительным числом. Окислительные числа атомов могут иметь положительное, нулевое и отрицательное значения.
17 Одиночные и кратные связи. Сигма- и пи- связи. При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или -типу. σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов. π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи из-за менее полного перекрывания р-АО. Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. По σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое вращение без разрыва связи (аним., ~33 Kб). Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
|
18 Концепция гибридизации атомных орбиталей и пространственное строение молекул и сложных ионов. Типы гибридизации sp, sp2, sp3, dsp3,d2sp3. Гибридизация с участием неподеленных электронных пар. Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным sp-гибридизацияПроисходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов. sp2-гибридизация Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей sp3-гибридизацияПроисходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
19Ионная связь. Простые и сложные ионы. Ионные кристаллические решетки. Концепция поляризации ионов. Связь такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Ионы могут быть простыми, т. е. состоящими из одного атома (например, катионы 1, анионы2,3), или сложными, т. е. состоящими из двух или более атомов, (например, катион 4, анионы5,6). Простые ионы, обладающие положительным зарядом, легче всего образуются из атомов элементов с низким потенциалом ионизации; к таким элементам относятся металлы главных подгрупп I и II группы. характерно для атомов типичных неметаллов, обладающих большим сродством к электрону. Поэтому к типичным соединениям с ионным типом связи относятся галогениды щелочных металлов, онными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, Основные положения теории поляризации, как известно, следующие. Подвижность электронов атома или иона определяется его размером и величиной заряда ядра: по мере роста заряда и уменьшения радиуса атома его электронная система становится все более жесткой, все менее способной к деформации. Отсюда ясно, что поляризуемость анионов, как правило, значительно выше, чем катионов |
20. Метод молекулярных орбиталей (МО). Связывающие и разрыхляющие МО, сигма- и пи- МО. Энергетические диаграммы МО и порядок заполнения орбиталей электронами для двухатомных молекул элементов 2 периода на примере молекул типа А2 , HF, LiF. Основные положения ММО, МО. 1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электронов. 2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны: АО s, p, d, f МО σ, π, δ, φ 3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе МО ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода). Рассмотрение химических связей в методе МО заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи. Молекулярная орбиталь, энергия которой меньше энергии атомной орбитали изолированного атома, называется связывающей (обозначается символом св), а находящиеся на ней электроны—связывающими электронами. Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом разр), а находящиеся на ней электроны — разрыхляющими электронами. Система МО молекулы Нг используется для построения электронных конфигураций двухатомных гомонуклеарных молекул. Заполнение молекулярных орбиталей происходит в соответствии с принципом наименьшей энергии и принципом Паули, по два электрона размещаются на о - и по четыре на вырожденных я - и В-орбиталях. Порядок, в котором возрастают энергии МО, устанавливается при исследовании молекулярных спектров и другими экспериментальными методами, а также при помощи квантовомеханических расчетов
21 Металлическая связь .Металлические кристаллические решетки . Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа. Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов характерные кристаллические решётки Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную. В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др. В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др. В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
|
22. Водородная связь. Природа и механизм образования водородной связи. Водородная связь возникает между молекулами, в которых атом водорода связан с атомом элемента, обладающего высокой электроотрицательностью. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода. Возникновение водородной связи обусловлено двумя причинами:1. Атом водорода, связанный полярной ковалентной связью с атомом X, фактически не имеет электронов и способен легко внедряться в электронные облака других частиц.2. Обладая вакантной s-орбиталью, атом водорода может принимать неподеленную электронную пару атома Y, образуя с ним донорно-акцепторную связь.Определенный вклад в образование водородной связи вносит электростатическое взаимодействие между положительно поляризованным атомом водорода в молекуле Н—X и отрицательно поляризованным атомом Y в другой молекуле. Чаще всего водородная связь образуется с участием атомов таких элементов, как кислород, фтор, азот. Наиболее типичный пример соединения с водородными связями — это вода. В жидком состоянии вода находится в виде ассоциатов (Н2О)n, а в кристаллах льда каждый атом кислорода образует по две водородные связи, что определяет его тетраэдрическое окружение
23
Силы межмолекулярного взаимодействия
(силы Ван-дер-Ваальса).
Ориентационное,
индукционное и дисперсионное
взаимодействие.Сила
Ван-дер-Ваальса,
сила межмолекулярного притяжения,
имеет три составляющие. Они обладают
несколько отличной физической природой,
но их потенциал зависит от расстояния
между молекулами одинаково – как
|
24 Зависимость физических свойств веществ с молекулярной структурой от характера межмолекулярного взаимодействия. Влияние водородной связи на свойства веществ.. Водородная связь существенно влияет на свойства веществ. Так, при ее наличии повышаются температура кипения, теплоты испарения и плавления, молекулы веществ в жидком состоянии становятся ассоциированными. Структура и свойства большинства органических веществ определяются образованием таких связей. Так, молекулы протеинов сохраняют свою спиральную форму из-за водородных связей. Они же удерживают вместе двойные спирали ДНК. Мерой энергии межмолекулярного взаимодействия могут служить температура кипения и теплота испарения ΔНисп жидкости. Для некоторых жидкостей эти величины приведены в табл. 6.1. повышение Ткип и ΔНисп при переходе от Аг к Хе обусловлено увеличением поляризуемости, а с увеличением размеров частиц и, как следствие, к усилению дисперсионного взаимодействия. Увеличение Ткип и ΔНисп при переходе от СН4 к С5Н12 связано с тем, что с удлинением углеводородной цепи увеличивается число точек соприкосновения между молекулами и усилением межмолекулярного взаимодействия. Сравнительно высокие значения Ткип и ΔНисп воды — следствие ассоциации в результате возникновения водородных связей.
|
|
25.Химические реакции-когда из одних веществ образуются иные вещества,непохожие по свойствам и составу на исходные. Классификация: Классификация по числу и составу реагентов и конечных веществ1. 1Реакции соединенияПри реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:A + B + C = D 2. Реакции разложенияРеакции разложения приводят к образованию нескольких соединений из одного сложного вещества:А = В + С + D. 3. Реакции замещенияПри реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:А + ВС = АВ + С. 4. Реакции обменаРеакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:АВ + СD = АD + СВ. По знаку теплового эффекта Экзотермические(с выделением теплоты)Эндотермические(идущие с поглощение теплоты) По признаку однородности Гомогенные(в однородной системе) Гетерогенные(в неоднородной системе В зависимости от наличия или отсутствия катаризарота Каталитические Некаталитические По признаку обратимости Обратимые(в 2 напрвлениях) Необратимые (в 1 напрвлении) Основные задачи химической кинетики расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени2) определение механизмов реакций по кинетическим кривым основные задачи химической термодинамики 1.предсказание о возможности протекания химической реакции; 2)онаправленностихимическойреакции; 3) о характере химического процесса.
26. Химическая система – совокупность реагирующих, взаимодействующих веществ. Функция состояния в термодинамике — функция независимых параметров, определяющих равновесное состояние термодинамической системы; Внутренняя
энергия - энергия движения и
взаимодействия частиц, из которых
состоит тело. Изменение внутренней энергии системы происходит при передаче энергии системе или от нее. Существует два основных способа передачи энергии - это передача теплоты и выполнение работы. Передача энергии, вызываемая разностью температур между системой и ее окружением или между одной системой и другой системой, называется ередачей теплоты. Выполнение работы.В химии работа чаще всего связана с расширением системы. Такое расширение происходит при выделении газа в ходе реакции.
27. Первое начало термодинамики —закон сохранения энергии:энергия изолированной системы,при любых происходящих в системе процессах не меняется,энергия не уничтожается и не создаётся.Энтальпия-потенциал,характеризующий состояние термодинамической системыH = U + pV Изменения энтальпии, происходящие при химической реакции, могут варьировать в зависимости от температуры, давления и физического состояния веществ, участвующих в рассматриваемом процессе. изменения энтальпии зависят от количества этих веществ
Закон
гесса:тепловой эффект реакции зависит
только от начального и конечного
состояния веществ и не зависит от
промежуточных стадий
процесса.Следствия:1Тепловой
эффект прямой реакции равен по величине
и противоположен по знаку тепловому
эффекту обратной реакции 2Тепловой
эффект химической реакции равен
разности сумм теплот
образования (ΔHf)
продуктов реакции и исходных веществ,
умноженных на стехиометрические коэффициенты
(ν): Под стандартной энтальпией образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, находящихся в устойчивыхстандартных состояниях.
|
28. необходимо учитывать два фактора - энтальпийный (H) и энтропийный (S) Оба фактора определяют движущую силу химической реакции и для установления возможности ее самопроизвольного протекания должны оцениваться одновременно. Энтропия-количественная мера беспорядка системы. 2закон термодинамики: теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении". все самопроизвольные процессы в природе идут с увеличением энтропии. 3закон Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю. Изменения энтропии С повышением температуры энтропия возрастает, Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого – в газообразное
29:энергия гиббса-термодинамическая функция состояния химической реакции стандартная энергия Гиббса образования ΔG°- изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии
В
химических процессах одновременно
действуют два противоположных
фактора — энтропийный (
30. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице объёма протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции). Факторы влияющие на скорость 1.природа реагирующих веществ 2.температура 3.концентрация 4.катализатор
Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. v = k cA cB, Энергия активации (Еа) - энергия, необходимая для достижения системой переходного состояния, называемого активированным комплексом Еа = Еперех.сост. - Еисх.сост Тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции. ΔH = Hкон. – Hисх. = Eкон. – Eисх. Уравне́ние
Арре́ниуса устанавливает
зависимость константы скорости химической
реакции
31.Катализ-ускорение направления химического процесса под действием катализаторов Катализаторы-вещества изменяющие скорость реакции,но при этом сами не расходуются. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный - образует самостоятельную фазу, Катализатор снижает энергию активации и направляет реакцию по другому пути
32. Механизм реакции – детальное ее описание с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей Кинетический порядок реакции по данному реагенту определяется путем изменения концентрации только этого реагента и оценки влияния такого изменения на суммарную скорость реакции. Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. Цепные реакции- химические реакции, которые, однажды начавшись, далее продолжают поддерживать сами себя до полного исчерпания участвующих в них веществ Примером первой, неразветвляющейся химической реакции может служить реакция соединения водорода с хлором. Эти элементы имеют столь большое тяготение друг к другу, что атом водорода легко отрывает от молекулы хлора и присоединяет к себе один из двух ее атомов или, наоборот, молекула хлора отрывает и присоединяет к себе от молекулы водорода один из ее двух атомов. Оставшийся свободным атом хлора тотчас же восполняет эту потерю, оторвав себе один из двух атомов оказавшейся по соседству другой молекулы водорода, и т. д. Так продолжается до тех пор, пока все атомы хлора не присоединят к себе по одной молекуле водорода или, наоборот, атомы водорода — по молекуле хлора. |
33. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций Обратимые-протекающие в двух напрвлениях,необратимые-в одном Константа химического равновесия характеризует сдвиг равновесия обратимой реакции в ту или иную сторону. Факторы,влияющие на константу:температура и давление Химическое равновесие-состояние обратимой реакции ,при котором скорость прямой=скорости обратной Катализ-изменение скорости химической реакции под действием катализатора Факторы влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической 2.давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, 3. концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ. Принцип ле-шателье:если на систему находящуюся в равновесии оказывается внешнее воздействие,то равновесение будет смещаться в сторону той реакции,которая противодействует этому воздействию.
35.растворы-гомогенные системы переменного состава,которые содержат два или несколько компонентов=) Дисперсные системы:грубодисперсные(размер частиц >100нм) суспензии, эмульсии, пены и аэрозоли, различающиеся по фазовому составу дисперсной фазы идисперсионной среды),коллоидные(размер частиц 1-10 нм) -(золь и гель),истинные(размер <1нм)-(ионные и молекулярные) разновидность растворов в котором размеры частиц растворенного вещества предельно малы и сопоставимы с размером частиц растворителя.
36.растворение- гетерогенное физ.-хим. взаимод. твердого тела и жидкости, сопровождающееся переходом твердой фазы в р-р
Растворение следует рассматривать как совокупность физических и химических явлений, выделяя при этом три основных процесса: 1) разрушение химических и межмолекулярных связей в растворяющихся газах, жидкостях или твердых телах ), требующее затраты энергии. Энтальпия системы при этом растет*: 2) химическое взаимодействие растворителя с растворяющимся веществом, вызванное образованием новых соединений — сольватов— и сопровождающееся выделением энергии. Энтальпия системы при этом уменьшается: 3) самопроизвольное перемешивание раствора или равномерное распределение сольватов в растворителе, связанное с диффузией и требующее затраты энергии. Энтальпия системы при этом растет: Растворение протекает самопроизвольно вплоть до насыщения раствора. изменение энтропии при растворении могут быть и положительными, и отрицательными Растворение кристаллических веществ часто идет с поглощением теплоты и обычно сопровождается ростом энтропии Изменения энергии Гиббса при растворении во всех случаях имеют положительные значения, которые увеличиваются с ростом температуры и убывают в ряду Не-Хе. Сольвация-взаимодействие между частицами растворенного вещества и растворителя. Сольваты-продукты переменного состава ,которые образуются при взаимодействии частиц раствор. Вещества с растворителем. Тепловой эффект-выделение или поглощение теплоты. Вода-наиболее универсальный растворитель, жидкость с максимальными величинами поверхностного натяжения, диэлектрической постоянной, теплоты парообразования и наивысшей (после аммиака) теплотой плавления. В отличие от большинства веществ вода, замерзая при низком давлении, расширяется. В молекуле воды ядра атомов водорода расположены несимметрично по отношению к ядру атома кислорода и электронам. Таким образом, четыре электрона располагаются на возможно наибольшем расстоянии как от ядра атома кислорода, так и от ядер атомов водорода, при котором они еще притягиваются ядром атома кислорода. Другие шесть электронов молекулы воды расположены так: четыре электрона находятся в положении, обеспечивающем химическую связь между ядрами атомов кислорода и водорода, а два других расположены вблизи ядра атома кислорода. Ассиметричное расположение атомов молекулы воды обусловливает неравномерное распределение электрических зарядов в ней, что делает молекулу воды полярной. Такое строение молекулы воды обусловливает притяжение молекул воды друг к другу в результате образования между ними водородных связей. Стремление молекул воды устанавливать водородные связи и их полярность объясняют необычно высокую растворяющую способность воды. Гидраты- продукты присоединения воды к неорганическим и органическим веществам. Кристаллогидраты-кристаллические вещества,содержащие молекулы воды.
37. Растворимость вещества – его качественная и количественная способность образовывать раствор при смешивании с растворителем. Растворимость жидкостей и твердых веществ обычно увеличивается при повышении температуры, поскольку при этом возрастает энергия движения молекул Изменение давления мало влияет на растворимость, так как объем при растворении меняется незначительно. Газ лучше растворяется при увеличении давления, под действием которого часть его молекул переходит в раствор. При повышении температуры растворимость газов снижается -
|
38 Концентрация раствора – это количество растворенного вещества, содержащегося в единице массы и объема раствора или растворителя.
М
Молярная концентрация эквивалента или нормальность – выражает число моль эквивалентов в одном литре раствора
Моляльная концентрация – число моль растворенного вещества на 1 кг растворителя
М
39. Электролиты - это вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся щелочи, растворимые соли и кислоты.В водных растворах электролиты распадаются на ионы. Неэлектролиты - вещества, растворы которых не проводят электрический ток. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав которых может изменяться непрерывным образом (по крайней мере, в некоторых пределах). В отличие от растворов электролитов. в растворы неэлектролитов (мол. растворах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. растворы неэлектролитов могут быть твердыми, жидкими и газообразными. ДИФФУЗИЯ-перенос частиц разной природы, обусловленный хаотич. тепловым движением молекул. О́смос— процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества. Осмотическим давлением называется сила, обусловливающая осмос. Осмотическое давление раствора прямо пропорционально концентрации растворенного вещества и пропорционально абсолютной температуре раствора. Правило Вант-Гоффа При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества. После подстановки χA = 1 – χB и несложных преобразований
40. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Факторы, определяющие склонность веществ к электролитической дис- социации: степень ионности связей, энергия связей, поляризуемость мо- лекул растворенного вещества, полярность молекул растворителя, взаи- модействие между молекулами растворителя и частицами растворенного вещества. Гидратация ионов – основная причина распада электролита на ионы. 41. Электролиты – кислоты, основания или соли, водные растворы которых проводят электрический ток в результате диссоциации. Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе. К сильным электролитам относятся: - растворимые соли; - многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI; - основания, образованные щелочными металлами (LiOH, NaOH, KOH и т.д.) и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2). Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы. Поэтому в уравнениях диссоциации слабых электролитов ставят знак обратимости (⇄). К слабым электролитам относятся: - почти все органические кислоты и вода; - некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.; - нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)2, Zn(OH)2 и др. Степень диссоциации (α) – это отношение числа продиссоциировавших (распавшихся) на ионы молекул (n) к общему числу растворенных молекул (N):
n
α = —
N Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается и обратна константе ассоциации.
Связь константы диссоциации и степени диссоциации Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A−] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α — степени диссоциации электролита. Тогда:
Это выражение называют законом разбавления Оствальда. При очень малых α (α<<1) K=cα² и
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает. ----------------------------------------
|
42. Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
Экспериментально определяемые для сильных электролитов степени диссоциации называют кажущимися (aкаж)
Активность ионов — величина, характеризующая состояние ионов в растворе, подстановка которой вместо концентрации в уравнения, определяющие фазовые или химические равновесия для идеальных растворов, делает эти уравнения применимыми к реальным растворам. Коэффициент активности — отношение активности данного компонента раствора к его концентрации, характеризующее отклонение свойств реальных растворов от свойств идеальных растворов. С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. В общем виде уравнение электролитической диссоциации основания имеет вид: Основание -> Катион основания + Гидроксид - ион
С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+. В общем виде уравнение электролитической диссоциации кислоты имеет вид: Кислота -> Катион водорода + Анион кислотного остатка
Соли. С точки зрения теории электролитической реакции соли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка. В общем виде уравнение электролитической диссоциации солей имеет следующий вид: Соль -> Катион основания + Анион кислотного остатка
Средние соли в водных растворах диссоциируют всегда в одну ступень: NaCI ® Na+ + CI - Al2(SO4)3 ® 2AI3+ + 3SO42-. Кислые соли диссоциируют ступенчато: KH2PO4 ® K+ + H2PO4-, H2PO4- HPO42- H+ + PO43-, Основные соли диссоциируют ступенчато: CuOHNO3 ® CuOH+ + NO3- (первая ступень), CuOH+ Cu2+ + OH- (вторая ступень).
Протонная теория Брёнстеда Согласно теории Бренстеда кислота является донором, а основание - акцептором протонов; кислоты и основания существуют только как сопряженные пары; протон не существует в растворе в свободном виде, в воде он образует катион оксония. Теория электролитической диссоциации Аррениуса Согласно Аррениусу кислотами являются электролиты, при диссоциации которых в водных растворах образуются ионы водорода (протоны) Основаниями Аррениуса являются электролиты, при диссоциации которых в водных растворах образуются гидроксид-ионы Электронная теория кислот и оснований, или Теория Льиса Электронная теория кислот и оснований является наиболее общей теорией кислот и оснований По Льису- кислоты - это вещества, способные принимать электронную пару (акцетор электронной пары), а основания - вещества, способные давать электронную пару (доноры электронной пары) Таким образом, теория кислот и оснований Бренстеда есть частный случай теории кислот и оснований Льюиса. 44. Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. Признаки необратимости реакции 1) Реакция идет с выделеним большого количества теплоты 2)хотя бы один продукт реакции покидает сферу реакции(выпадает осадок) 3)в результате реакции образуется малодиссоциируемые вещества. 45.
К равновесным системам следует отнести
также и систему труднорастворимый
электролит – его насыщенный раствор.
В этом случае мы имеем дело с динамическим
гетерогенным равновесием
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO4 с ПР = 2,5∙10–5 и BaSO4 с ПР = 1,1∙10–10, большей растворимостью обладает та соль, у которой ПР больше. 46. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды. Водоро́дный показа́тель, pH — мера активности ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
pH воды - один из важнейших рабочих показателей качества воды, во многом определяющих характер химических и биологических процессов, происходящих в воде. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д.
Диссоциация воды
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы): H2O ↔ H+ + OH-
|
47. Гидролиз (от греч. hydro – вода, lysis – разложение) означает разложение вещества водой. Гидролизом соли называют обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита.Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»). Различают обратимый и необратимый гидролиз солей[1]:
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа). Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация. Образование кислых и основных солей имеет большое значение при объяснении процессов гидролиза ( см. § 6, гл. [1] Их ступенчатая диссоциация обусловливает образование кислых и основных солей. [2] Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [3] Ступенчатая диссоциация обусловливает возможность образования кислых и основных солей. [4] Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [5] Ступенчатость диссоциации кислот и оснований обусловливает возможность образования кислых и основных солей. Известны электролиты, которые при диссоциации образуют и ионы водорода и ионы гидроксила. Такие соединения называются амфотерными электролитами. ____________________________________________________________ 48.константу гидролиза можно выразить через: Kw-ионное произведение воды Kg-константа диссоциации 49. Окисли́тельно-восстанови́тельные реа́кции, ОВР,— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования. В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
Важнейшие восстановители и окислители
Окислители Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Метод электронного балланса В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах. Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем. Уравнение составляется в несколько стадий: 1. Записывают схему реакции. KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O 2. Проставляют степениокисления над знаками элементов, которые меняются. KMn+7O4 + HCl-1 ® KCl + Mn+2Cl2 + Cl20 + H2O 3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем. Mn+7 + 5ē ® Mn+2 2Cl-1 - 2ē ® Cl20 4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
–––––––––––––––––––––––– 2Mn+7 + 10Cl-1 ® 2Mn+2 + 5Cl20 5. Подбирают коэффициенты для всех остальных участников реакции. 2KMn+7O4 + 16HCl-1 ® 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается обмен электронами между ионами в растворе с учетом характера среды _______________________________ 50. Электродный потенциал, разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродный потенциал обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
|
51.Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают вмилливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
Положительный окислительно-восстановительный потенциал электрода Cu2+│Cu (E° = +0,34 B) показывает, что в стандартных условиях водород окисляется ионами меди, медный электрод по отношению к водороду является катодом, электроны по внешней цепи переходят от водорода к меди:
|
|
|
Отрицательный потенциал Zn2+│Zn (E° = –0,76 B) означает, что в стандартных условиях цинковый электрод может быть только анодом, его окислительные функции по отношению к водородному электроду 2H+│H2 отрицательные. Цинк здесь восстанавливает катионы водорода, электроны во внешней цепи перетекают от цинка к водороду:
|
|
|
Суммируя эти реакции, получим
|
|
|
то есть электрод с более положительным значением стандартного электродного потенциала является окислителем по отношению к электроду с менее положительным значением E°.
52.Для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций используют два основных метода – электронный баланс и ионно-электронный метод (метод полуреакций).
Электронный баланс основан на схематической записи изменения степеней окисления окислителя и восстановителя по отдельности и уравнивания числа переданных электронов. Например, для реакции описываемой схемой
NH3 +
O2 ![]() N2 +
H 2O
N2 +
H 2O
сначала определяем элементы, меняющие свои степени окисления. В левой у азота степень окисления -3, в правой – 0. Азот повышает свою степень окисления и является восстановителем.
N-3 N0
В ходе реакции элемент азот окисляется и, следовательно, отдает электроны. Для того, чтобы выполнялся закон сохранения заряда, один азот должен отдать три электрона:
N-3 - 3е N0
С учетом того, что в правой части схемы записана молекула азота, удваиваем все коэффициенты:
2N-3 - 6е N20
В левой части кислород имеет степень окисления 0, в правой -2, т. е. понижает свою степень окисления и в данной реакции является окислителелем:
О0 О-2
Для этого атому кислорода необходимы два электрона:
О0 + 2е О-2
![]()
С учeтом того, что в реакции участвует молекулярный кислород, окончательно для кислорода получим:
О20 + 4е 2O-2
Запишем процессы окисления и восстановления в одну схему:
![]()
Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем, поэтому домножаем обе полуреакции на коэффициенты, которые доводят число электронов в каждом процессе до наименьшего общего кратного. Этот коэффициент для первой полуреакции равен 2, для второй - 3, при этом число электронов в обоих полуреакциях будет по 12:
![]()
Из полученной схемы следует, что в левой части должно быть 4 атома азота в степени окисления -3, следовательно у аммиака коэффициент равен 4, в правой части будет две молекулы азота. В левой части коэффициент у молекулярного кислорода равен 3, в правой части должно быть 6 атомов кислорода в степени окисления -2. Получаем уравнение:
4NH3 + 3O2 = 2N2 + 6H2O
Проверяем число атомов водорода в обеих частях - в левой 12 и в правой 12.
Метод электронного баланса применяется для составления уравнений окислительно восстановительных реакций, протекающих в газовой или твердой фазе, если реакция протекает в растворе или расплаве с участием электролитов, то используется метод электронно-ионного баланса (метод полуреакций).
Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (aM) уравнение Нернста упрощается:
|
|
|
Потенциал
электрода, как видно из этого уравнения,
зависит от активности ионов ![]() которые
являются потенциалопределяющими.
Разность потенциалов стандартного
водородного электрода и какого-нибудь
другого электрода, измеренная при
стандартных условиях, называется
стандартным электродным потенциалом
и обозначается E°.
которые
являются потенциалопределяющими.
Разность потенциалов стандартного
водородного электрода и какого-нибудь
другого электрода, измеренная при
стандартных условиях, называется
стандартным электродным потенциалом
и обозначается E°.
Следует подчеркнуть, что:
Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная.
В дробном индексе при E и E° над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная.
Активности твердых веществ в уравнение Нернста не входят.
52. Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называетсякомплексообразователем (центральным ионом). Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или нейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу. Остальные ионы находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу.
Количество лигандов, окружающих центральный ион, называется координационным числом.
Внутренняя сфера комплекса в значительной степени сохраняет стабильность в растворе (ее границы в формуле показывают квадратными скобками). Ионы внешней сферы в растворе легко отщепляются.
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>).
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость. Так, для элементов-комплексообразователей, имеющих степень окисления +I (AgI, CuI, AuI, II и др.) наиболее характерно координационное число 2 – например, в комплексах типа [Ag(NH3)2]+, [Cu(CN)2], [IBr2]
Элементы-комплексообразователи со степенью окисления +II (ZnII, PtII, PdII, CuII и др.) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn(NH3)4]2+, [PtCl4]2, [Pd(NH3)2Cl2]0,[ZnI4]2, [Cu(NH3)4]2+.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H2O)6]2+, [Mg(H2O)6]2+, [Ni(H2O)6]2+.
Элементы-комплексообразователи, обладающие степенью окисления +III и +IV (PtIV, AlIII, CoIII, CrIII, FeIII), имеют в комплексах, как правило, КЧ 6. Например, [Co(NH3)6]3+, [Cr(OH)6]3, [PtCl6]2, [AlF6]3, [Fe(CN)6]3
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах [Al(OH)4] и[Al(H2O)2(OH)4].
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9[Bi(NCS)12].
Заряд комлексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов.
53. По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия Li[AlH4] — тетрагидридоалюминат(III) лития K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель [Pt(NH3)2Cl2] — дихлородиамминплатина(II)
По числу мест, занимаемых лигандами в координационной сфере
![]()
Структура комплексного иона, образованного катионом металла и анионом ЭДТА
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
54. Природа химической связи в КС принципиально не отличается от ее природы в простых соединениях.
Во внутренней сфере между комплексообразователем и лигандами формируются полярные ковалентные связи. Частицы внешней сферы удерживаются около комплекса за счет электростатического ионного взаимодействия, т.е. характер связи преимущественно ионный.
Для объяснения химической связи в КС используют три основных концепции: методы валентных связей (ВС) и молекулярных орбиталей (МО), теорию кристаллического поля (ТКП).
Рассмотрим более простой, но достаточно универсальный метод ВС. Химическую связь в комплексе, т.е. между комплексообразователем и лигандами обычно объясняют с позиций донорно-акцепторного механизма. При этом, как правило, лиганды предоставляют неподеленные электронные пары, а комплексообразователи - свободные орбитали.
Для оценки возможности протекания реакции замещения лигандов можно использовать спектрохимический ряд, руководствуясь тем, что более сильные лиганды вытесняют из внутренней сферы менее сильные.
55. В растворах комплексных соединений могут происходить разнообразные сложные превращения, определяемые природой как самого комплексного соединения, так и растворителя. Это, во-первых, диссоциация на комплексные и внешнесферные ионы, затем – диссоциация комплексного иона или нейтрального комплекса, сопровождаемая замещением лиганда во внутренней сфере на молекулы растворителя. Кроме того, комплексы могут участвовать в разнообразных окислительно-восстановительных процессах, если в состав комплексного иона или растворителя входят ионы или молекулы с ярко выраженными окислительными или восстановительными свойствами.
5.1. Комплексные соединения без внешней сферы
Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты. К неэлектролитам относят прежде всего внутрикомплексные соединения (или хелаты), затем –карбонилы металлов и -комплексы и некоторые другие.
Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты.
5.2. Отщепление ионов внешней сферы
Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации на комплексный ион и ионы внешней сферы. Они ведут себя в разбавленных растворах как сильные электролиты: диссоциация протекает моментально и практически нацело. Примеры такого рода:
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42
K3[Fe(CN)6] = 3 K+ + [Fe(CN)6]3
Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание (диссоциация идет нацело, рН 7). Пример соединения этого типа – гидроксид тетраамминцинка(II):
[Zn(NH3)4](OH)2 = [Zn(NH3)4]2+ + 2 OH
Комплексные соединения с внешнесферными катионами водорода (типа гексафторосиликата водорода или тетрафторобората водорода) в водном растворе нацело подвергаются протолизу. Они являютсясильными кислотами:
H[BF4] + H2O = [BF4] + H3O+
5.3. Обратимая диссоциация комплексов
Однако на отщеплении внешнесферных ионов процесс электролитической диссоциации не заканчивается. Комплексные ионы, в свою очередь, подвергаются обратимой электролитической диссоциации, уже как слабые электролиты, по схеме :
[MLn] ![]() M
+ n L
M
+ n L
Такая диссоциация, разумеется, протекает ступенчато: лиганды удаляются из внутренней сферы постепенно, один за другим (точнее, происходит реакция замещения лиганда на молекулы растворителя - воды).
Для упрощения записи в качестве примера взят незаряженный комплекс, а продукт диссоциации представлен в негидратированном виде.
Аналогичным образом происходит и обратный процесс - образование комплекса. Сначала во внутренней сфере появляется один лиганд, затем второй, третий и так далее:
M + L [ML]
[ML] + L [ML2]
[ML2] + L [ML3]
…….
[ML(n1)] + L [MLn]
Процесс комплексообразования завершается, когда число присоединившихся монодентатных лигандов L станет равным координационному числу комплексообразователя M. При этом устанавливаетсядинамическое равновесие, поскольку наряду с образованием комплексов идет и их диссоциация.
5.4. Ступенчатая и полная константы образования
Состояние равновесия реакций комплексообразования можно охарактеризовать ступенчатой константой образования Ki(обр) комплекса, а именно:
M + L [ML]; K1(обр) = [ML] / {[M] [L]}
[ML] + L [ML2]; K2(обр) = [ML2] / {[ML] [L]}
Для n-ой ступени комплексообразования ступенчатая константа образования Kn равна:
[ML(n1)] + L [MLn]; Kn(обр) = [MLn] / {[ML(n1)] [L]}
Существует и другой способ описания равновесия при комплексообразовании – с помощью полных (или суммарных) констант образования данного комплекса i(обр):
M + L [ML]; 1(обр) = [ML] / {[M] [L]}
M + 2 L [ML2]; 2(обр) = [ML2] / {[M] [L]2}
M + 3 L [ML3]; 3(обр) = [ML3] / {[M] [L]3}
…….
M + n L [MLn]; n(обр) = [MLn] / {[M] [L]n}

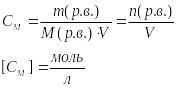 олярная
концентрация
– характеризует число молей растворенного
вещества в одном литре раствора
олярная
концентрация
– характеризует число молей растворенного
вещества в одном литре раствора