
- •Тема 1. Введение. Основы современной теории строения органических соединений
- •Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •Тема 2. Химическая связь и взаимовлияние атомов в органических соединениях.
- •Тема 3. Химическое строение и изомерия органических соединений
- •Тема 4. Кислотность и основность органических веществ.
- •Тема 5. Радикальные и электрофильные реакции органических соединений
- •Тема 6. Конкурирующие реакции нуклеофильного замещения и элиминирования у насыщенного атома углерода
- •Тема 7. Нуклеофильные реакции в ряду карбонильных соединений
- •Тема 8. Окислительно-восстановительные реакции органических соединений.
- •Тема 9. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •Тема 10. Биологически важные гетероциклические соединения
- •Тема 11. Аминокислоты, пептиды, белки
- •Тема 12. Углеводы: моно, ди- и полисахариды
- •Тема 13. Нуклеотиды и нуклеиновые кислоты
- •Тема 14. Липиды и низкомолекулярные биорегуляторы
Тема 11. Аминокислоты, пептиды, белки
Строение и свойства аминокислот и пептидов.
Аминокислоты — соединения, в молекулах которых одновременно присутствуют амино- и карбоксильные группы. Природные -аминокислоты являются биологически активными соединениями
Строение аминокислот. Все -аминокислоты можно рассматривать как результат замены атома водорода в простейшей -аминокислоте – глицине – на тот или иной радикал R. Таким образом, в соответствии с природой радикала R, называемого боковой цепью, -аминокислоты подразделяют на 4 группы, отличающиеся гидрофильностью или гидрофобностью боковых цепей, а также способностью боковой цепи проявлять кислотные или основные свойства.
Стереохимия природных -аминокислот характеризуется тем, что все они, кроме глицина, имеют асимметрический атом углеродa (атом, связанный и с амино-, и с карбоксильной группой), конфигурация которого может быть отождествлена с конфигурацией L- глицеринового альдегида путем цепи химических превращений:
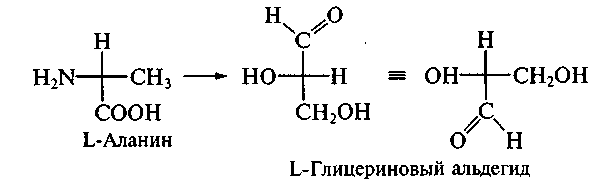
Превращения либо не должны затрагивать хиральный центр, либо должны протекать строго стереоспецифично. Следовательно, все природные -аминокислоты являются энантиомерами.
Конфигурация асимметрического центра аминокислот определяет биологические свойства как самих аминокислот, так и олиго- и полимерных соединений, мономерами которых служат остатки аминокислот (эти соединения называют пептидами).
Свойства аминокислот. Аминокислоты представляют собой бесцветные кристаллические вещества с довольно высокими температурами плавления (более 230 °С). Большинство кислот хорошо растворимы в воде и практически не растворимы в спирте и диэтиловом эфире, что указывает на солеобразный характер этих веществ. Специфическая растворимость аминокислот обусловлена наличием в молекуле одновременно аминогруппы (основный характер) и карбоксильной группы (кислотные свойства), благодаря чему аминокислоты принадлежат к амфотерным электролитам (амфолитам).
![]()
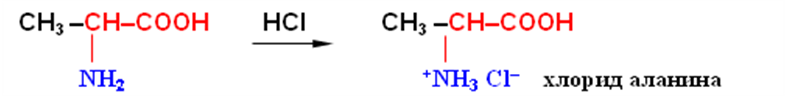
В водных растворах и твердом состоянии аминокислоты существуют только в виде внутренних солей — цвиттер-ионов.
Кислотно-основное равновесие для аминокислоты может быть описано:
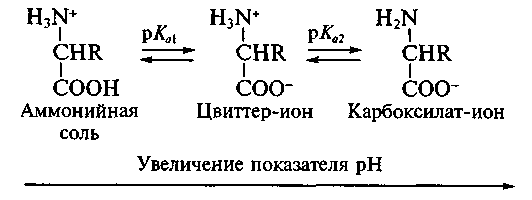
Если к раствору аминокислоты приложено электрическое поле, то в зависимости от показателя рН раствора ионы аминокислоты будут перемещаться по-разному: в кислой среде при рН < 7 аммонийные ионы аминокислот перемещаются к отрицательному полюсу (катоду), а в щелочной среде при рН > 7 карбоксилат-ионы — к положительному полюсу (аноду). Значение рН, при котором молекула аминокислоты электронейтральна, называют изоэлектрической точкой и обозначают рI. При значении рН, равном показателю рI, молекула аминокислоты в электрическом поле не перемещается.
Наличие в молекуле одновременно амино- и карбоксильной группы отражается и на поведении аминокислот в тех реакциях, в которых участвует только одна из двух функциональных групп.
С участием карбоксильной группы могут протекать все реакции, характерные для карбоновых кислот с образованием соответствующих производных карбоновых кислот (сложных эфиров, ангидридов, амидов и т.п.).
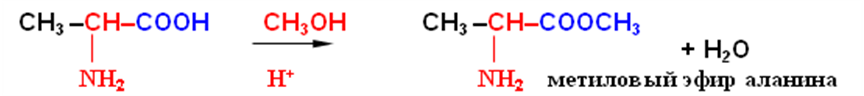

При этом надо помнить о том, что аминогруппа легко окисляется, поэтому, например, для получения галогенангидридов аминокислот требуется предварительное ацилирование аминогруппы. После получения галогенангидрида ацильная защита гидролизуется.
Одна из важнейших реакций в организме — декарбоксилирование аминокислот. Отщепление СО2 происходит под действием особых ферментов — декарбоксилаз:
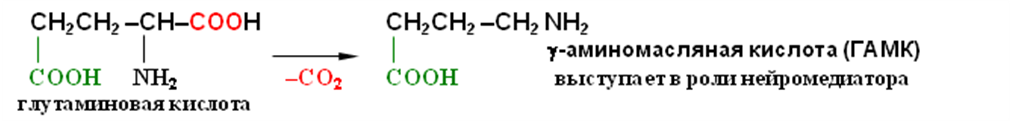
Аминогруппа, которая в аминах проявляет себя как нуклеофил, в биполярном ионе полностью лишена нуклеофильности из-за протонирования, поэтому ни реакция алкилирования по Гофману, ни ацилирование, свойтвенные аминам, не имеют места в случае аминокислот. Эти реакции могут происходить только при условии предварительного депротонирования аминогруппы, что достигается использованием реакционной среды с высоким значением рН, при которых цвиттер-ион полностью превращен в карбоксилат-анион.
Алкилирование осуществляют, действуя на полученные соли минокислот алкилгалогенидами в присутствии оснований (как органических, так и неорганических).
Ацилирование также требует предварительного превращения цвиттер-иона в карбоксилат-анион и успешно протекает при наличии в реакционной среде эквивалента основания (основание необходимо для связывания, выделяющегося при ацилировании кислого продукта – галогеноводорода или карбоновой кислоты).
![]()
Образование оснований Шиффа (как типичная реакция аминов) свойственно и аминокислотам; наиболее часто используют реакции аминокислот с бензальдегидом:
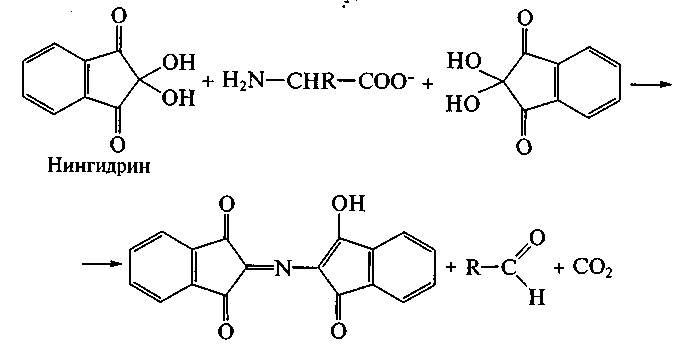
На образовании оснований Шиффа основана реакция идентификации аминокислот, известная как «нингидриновая проба», широко применяемая для визуализации зон аминокислот (возникает интенсивное сине-фиолетовое окрашивание) при их хроматографическом и электрофоретическом разделении, а также для количественного определения содержания аминокислот в растворах:
Дезаминирование аминокислот, как и всякого первичного амина, протекает при действии на аминокислоты азотистой кислоты. Эта реакция лежит в основе метода определения содержания азота и количества аминогрупп в аминокислотах (метод Ван-Слайка).
![]()
Биосинтез аминокислот. Все природные -аминокислоты делят на незаменимые (валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин), которые поступают в организм только из внешней среды, и заменимые, синтез которых происходит в организме. Биосинтез -аминокислот может происходить на основе не аминокислот, например по реакции восстановления -кетокислот под действием НАДН. Реакция стереоспецифична вследствие стереоспецифичности НАДН.
В качестве исходных веществ при биосинтезе аминокислот могут выступать другие аминокислоты. Например, реакция транс-аминирования (переаминирования) является основной при синтезе -аминокислот в организме.
Катализаторами и участниками этого процесса являются ферменты (аминотрансферазы) и кофермент пиридоксальфосфат, который служит переносчиком аминогруппы.
Пептиды. Амино- и карбоксильные группы аминокислот могут реагировать друг с другом, даже если они находятся в одной молекуле. Еще более реальным является образование межмолекулярной амидной связи. Амиды, образовавшиеся в результате взаимодействия некоторого числа аминокислот, называют пептидами. В зависимости от числа аминокислотных остатков различают ди-, три-, тетра-, пентапептиды и т.д. При этом пептиды молекулярной массой не более 10 000 называют олигопептидами, молекулярной массой более 10 000 — полипептидами, или белками. Амидные связи в составе пептидов называют пептидными.
Пептидная группировка характеризуется рядом свойств.
1. Пептидная группировка имеет жесткую планарную структуру, т. е. все атомы, входящие в нее, располагаются в одной плоскости.
2. Атомы кислорода и водорода пептидной группировки природных пептидов и белков находятся в транс-положении по отношению к связи С—N, так как при транс-конфигурации заместителей боковые цепи оказываются наиболее удалены друг от друга, что важно для стабилизации структуры белковой молекулы.
3. Пептидная группа представляет собой трехцентровую р,-сопряженную систему, которая образуется вследствие делокализации электронной плотности между атомами кислорода, углерода и азота. Длины связей С–О и С–N оказываются практически одинаковыми.
4. Пептидная связь устойчива при температуре 310 К в средах, близких к нейтральной (физиологические условия). В кислой и щелочной средах связь подвергается гидролизу. В условиях организма гидролиз происходит ферментативно.
5. Дополнительные, как правило, нековалентные, связи между пептидной группой и боковыми цепями обусловливают существование различных конформаций белковой молекулы. Например, внутримолекулярные водородные связи (N—Н--О=С) стабилизируют вторичную структуру белка.
6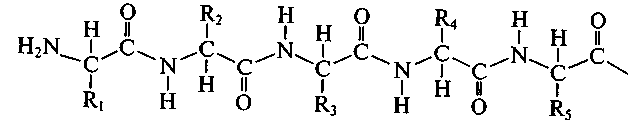 .
Пептидная группировка может существовать
в двух резонансных формах (кетонной и
енольной). Эти свойства пептидной
группировки определяют строение
полипептидной цепи:
.
Пептидная группировка может существовать
в двух резонансных формах (кетонной и
енольной). Эти свойства пептидной
группировки определяют строение
полипептидной цепи:
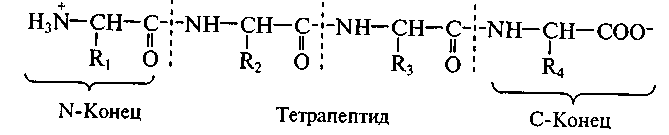
Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков – боковых радикалов аминокислотных остатков. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец).
Как правило, при изображении формулы пептида N-конец располагают слева, а С-конец — справа:
Называют пептид, последовательно перечисляя, начиная с N-конца, названия аминокислот, входящих в пептид; при этом суффикс «-ин» заменяют на суффикс «-ил» для всех аминокислот, кроме С-концевой. Для описания строения пептидов применяют не традиционные структурные формулы, а сокращенные обозначения, позволяющие сделать запись более компактной.
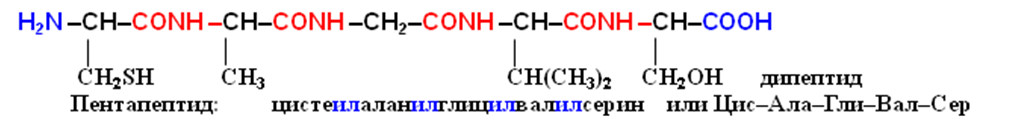
Понятие «строение пептида» (равно как и «первичная структура белка») включает в себя следующие характеристики:
1) общее число аминокислотных остатков;
2) перечень аминокислот, входящих в состав пептида, и указание количества аминокислотных остатков каждого вида (аминокислотный состав пептида или белка);
3) последовательность связывания аминокислот друг с другом (этот параметр называют аминокислотной последовательностью; он отражает так называемую первичную структуру пептида или белка); последовательность записывают слева направо от N-конца к С-концу.
Метод Эдмана (определение первичной структуры полипептида) заключается во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи «меченой» концевой ФТГ-аминокислоты. ФТГ-аминокислота идентифицируется методами тонкослойной или газожидкостной хроматографии. Преимущество метода Эдмана состоит в том, что при отщеплении каждой концевой -аминокислоты остальная часть пептидной молекулы не разрушается и операции по отщеплению можно повторять.
Метод Эдмана пригоден для воспроизведения на автоматическом приборе – секвенаторе.
Особенности растворения полимеров. Размеры макромолекул высокомолекулярных соединений (ВМС) соизмеримы с размерами коллоидных частиц, что обусловливает общность ряда свойств, характерных для коллоидных растворов и растворов ВМС.
К таким свойствам относят малую скорость диффузии растворенных частиц, неспособность их проникать через мембраны, эффект Фарадея-Тиндаля и др. Однако растворы ВМС являются истинными, поскольку удовлетворяют основным критериям истинных растворов: самопроизвольность образования, гомогенность, термодинамическая устойчивость, равновесность.
Равновесие в растворах ВМС устанавливается медленнее, чем в истинных растворах, и, растворению, как правило, предшествует набухание. Набуханием называют самопроизвольный процесс односторонней диффузии низкомолекулярного растворителя в полимер, сопровождающийся увеличением объема и массы ВМС.
Различают неограниченное и ограниченное набухание. В первом случае полимер поглощает жидкость, а потом при той же температуре постепенно переходит в раствор (растворение желатина или крахмала в горячей воде). При ограниченном набухании процесс практически останавливается на стадии образования гетерогенной системы, состоящей из двух фаз: набухший полимер и низкомолекулярный растворитель. В этом случае равновесной системой является гель. Пример ограниченного набухания — набухание желатина или крахмала в холодной воде, набухание резины в бензоле. Тип набухания зависит от гибкости полимерной цепи: чем более гибкой является полимерная цепь, тем больше степень набухания и тем выше вероятность образования раствора. Количественно способность полимера набухать в тех или иных растворителях характеризуют степенью набухания.
Для амфотерных полиэлектролитов степень набухания зависит от рН среды. Белки в изоэлектрическом состоянии имеют минимальные значения степени гидратации, набухания, растворимости. Зависимость степени набухания белка от рН среды выражается кривой с двумя максимумами и одним минимумом, который соответствует изоэлектрической точке.
Качественные реакции. Для идентификации некоторых пептидов и белков используют так называемые «цветные реакции».
Универсальная реакция на пептидную группу — появление красно-фиолетовой окраски при добавлении к раствору белка ионов меди (II) в щелочной среде (биуретовая реакция).
Реакция на остатки ароматических аминокислот — тирозина и фенилаланина — появление желтой окраски при обработке раствора белка концентрированной азотной кислотой (ксантопротеиновая реакция).
Серасодержащие белки дают черное окрашивание при нагревании с раствором ацетата свинца(II) в щелочной среде (реакция Фоля).
По составу белки подразделяются на простые (неконъюгированные) и сложные (конъюгированные). При гидролизе простых белков в качестве продуктов расщепления получаются только -аминокислоты. Сложные белки наряду с собственно белковой частью, состоящей из - аминокислот, содержат органическую или неорганическую части непептидной природы, называемые простетическими группами.
Примерами сложных белков могут служить транспортные белки миоглобин и гемоглобин, в которых белковая часть — глобин — соединена с простетической группой — гемом. По типу простетической группы их относят к гемопротеинам. Фосфопротеины содержат остаток фосфорной кислоты, метал-лопротеины — ионы металла.
Пространственное строение полипептидов и белков
Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны более высокие уровни организации, которые принято называть вторичной, третичной и четвертичной структурами.
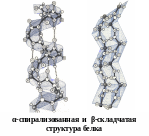
Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная – трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структуры связаны с упорядоченным расположением макромолекулярной цепи в пространстве. Вторичная структура закрепляется, как правило, с помощью водородных связей между пептидными группами, довольно близко расположенными в цепи α-аминокислотных остатков. Ее основные виды — α-спираль и β-структура. Третичная структура (глобулярная или фибриллярная) стабилизируется не только водородными связями, но и другими видами взаимодействий, например ионным, гидрофобным, а также «сульфидными» связями.
Первые три уровня характерны для структурной организации всех белковых молекул. Четвертый уровень встречается при образовании единых белковых комплексов, состоящих из нескольких полипептидных цепей.
О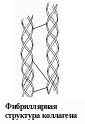

 пределяющее
значение в формировании более высоких
уровней организации белковых молекул
имеет их первичная структура. Природа
α-аминокислотных остатков и порядок их
соединения обусловливают характер
стабилизации более высокоорганизованных
структур.
пределяющее
значение в формировании более высоких
уровней организации белковых молекул
имеет их первичная структура. Природа
α-аминокислотных остатков и порядок их
соединения обусловливают характер
стабилизации более высокоорганизованных
структур.
Контрольные задания
1. Из представленных соединений выберите изомер глутаминовой кислоты по функциональной группе
а) НООС–СН2СН2СН(ОН)–СОNH2; б) H2NCО–СН2СН2СН(NН2)–COOH;
в) HOOC–СН2CH(NH2)СН2–COOH; г) HOOC–СН2CH(NH2)–COOH.
2. Какую среду покажет раствор лизина при растворении в дистиллированной воде: а) нейтральную; б) слабокислую; в) слабощелочную?
3. Какая кислота образуется при дезаминировании валина in vitro:
а) 3-метил-2-оксобутановая; б) 3-метил-2-бутеновая; в) 2-метил-3-оксобутановая; г) 2-гидрокси-3-метилбутановая; д) 2-метилбутандиовая?
4. Какое органическое соединение получится из серина при действии на него фермента декарбоксилазы: а) 2-амино-1-этанол; б) 2-аминопропановая кислота; в) 3- гидроксипропановая кислота; г) 3-оксо-2-аминопропановая кислота; д) пропандиовая кислота?
5. Реакция на серусодержащие аминокислоты (реакция Фоля) меняет окраску раствора аминокислоты от бесцветной до: а) жёлтой, б) сине-фиолетовой, в) васильковой, г) чёрной.
6. При взаимодействии с конц. азотной кислотой раствор аминокислоты приобрёл жёлтый цвет, перешедший в оранжевый при подщелачивании (ксантопротеиновая реакция). Это был раствор: а) аланина, б) серина, в) аспарагина, г) тирозина, д) метионина?
7. Вторичная структура белка — это: а) последовательность аминокислотных остатков в полипептидной цепи; б) укладка полипептидной цепи в виде спирали или складчатой структуры; в) укладка полипептидной цепи в трёхмерную конфигурацию; г) комплекс из нескольких отдельных полипептидных цепей.
8. Закрепление конформации в третичной структуре белка происходит, в основном, за счёт связей: а) водородных; б) ионных; в) гидрофобных (силы Ван-дер-Ваальса); г) кислородных; д) азотных; е) дисульфидных.
9. Приведите структурную формулу лейцина и сокращённое обозначение его аминокислотного остатка. Назовите эту аминокислоту по правилам международной номенклатуры. Приведите (если это возможно) один изомер положения функциональной группы, один изомер функциональной группы и один изомер строения углеродного скелета. Изобразите L и D- энантиомеры.
