
Экзаменационный билет № 5
Проблема вида и видообразования. Представления о микро- и макроэволюции.
Микроэволюционные процессы, протекающие в популяциях, не сводятся только к формированию приспособлений, они могут приводить к образованию новых видов.
Схему видообразования Ч. Дарвин строил на основе выдвинутых им принципов монофилии и дивергенции . Монофилия - происхождение потомков от одного родоначального предка. Дивергенция - расчленение родоначальной формы на два и более дочерних, внучатых и т.д. видов ( рис. 27 ).
Наиболее острая конкуренция должна происходить между наиболее сходно устроенными особями данного вида (в силу сходства их жизненных потребностей). Вот почему в более благоприятных условиях окажутся уклонившиеся от среднего состояния дочерние формы. Они получают преимущественные шансы на выживание и оставление потомства. Наоборот, предковая и промежуточные формы, более сходные друг с другом, имеют мало шансов победить в борьбе за существование. В итоге от общего предка в ходе эволюции должны возникать все более разнообразные и отличающиеся друг от друга потомки.
Изоляция - ключевой фактор видообразования. У организмов, размножающихся половым путем, вид представляет собой сложную мозаику популяций. Пока особи разных популяций внутри вида хоть изредка могут скрещиваться в природе и давать плодовитое потомство, т.е. пока существует ноток генетической информации между популяциями, вид остается целостной и единой системой. Однако в результате сильного давления изоляции поток генов может прерваться и изолированные популяции, накопив изменения под влиянием всегда действующих элементарных эволюционных факторов, могут перестать скрещиваться при последующих встречах. Возникновение репродуктивной изоляции между разными популяциями означает разделение одного вида на два, т.е. идет процесс видообразования. Значит, вопрос о том, как образуются новые виды, тождествен вопросу, как между популяциями внутри вида возникает репродуктивная изоляция.
Наиболее изученный путь образования видов - это постепенное видообразование, осуществляющееся в процессе микроэволюции. Оно приводит к постепенной дивергенции популяций внутри вида до полного разобщения молодых дочерних видов, что согласуется с классической дарвиновской концепцией происхождения видов.
Постепенное видообразование в зависимости от характера изоляции может быть географическим и экологическим .
Эволюция на уровне систематических единиц выше вида, протекающая миллионы лет и недоступная поэтому непосредственному изучению, называется макроэволюцией . Термины "микро-" и "макроэволюция" были предложены в 1920-е годы, отечественным генетиком Ю.А. Филипченко. Процессов макроэволюции мы непосредственно не видим, но можем наблюдать их результаты: современные организмы или остатки живших ранее существ.
Эволюция, идущая на уровне ниже вида (популяций , подвидов ) и завершающаяся видообразованием, называется микроэволюцией. Микроэволюционные явления и процессы нередко совершаются в сроки, доступные непосредственному наблюдению.
Микроэволюционные процессы - изменения в пуле генов вида или популяции, происходящие на протяжении нескольких генераций. Микроэволюционные процессы соответствуют мелким эволюционным изменениям, например, изменениям в частотах аллелей .
Особенности наследования количественных признаков.
При изучении наследования так называемых качественных признаков такая степень гетеро- зиготности исключительно редка. В то же время при изучении генетического контроля признаков продуктивности растений и животных — урожайности, скорости роста — расщепление в потомстве гибридов редко происходит менее чем по 16 генам.
Первая важная особенность элементов продуктивности — их непрерывное варьирование, характерное для всех количественных, т. е. мерных, признаков, к которым относятся масса, рост животных, молочность, яйценоскость и др. То же самое справедливо и для мерных признаков растений.
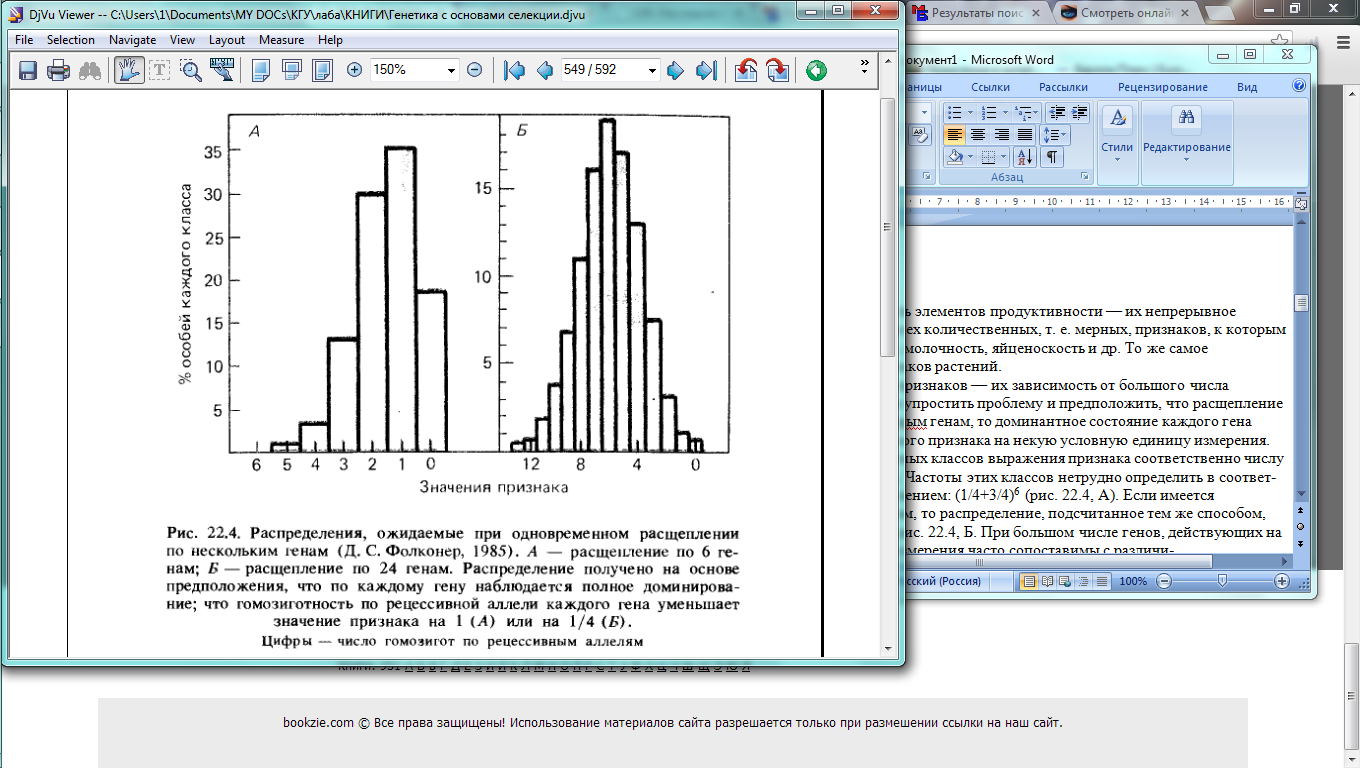
Вторая особенность этих признаков — их зависимость от большого числа взаимодействующих генов. Если упростить проблему и предположить, что расщепление происходит по шести несцепленным генам, то доминантное состояние каждого гена увеличивает проявление изучаемого признака на некую условную единицу измерения. Тогда должно быть семь дискретных классов выражения признака соответственно числу доминантных генов: 0, 1, 2 и т. д. Частоты этих классов нетрудно определить в соответствии с биномиальным распределением: (1/4+3/4)6 (рис. 22.4, А). Если имеется гетерозигота не по 6, а по 24 генам, то распределение, подсчитанное тем же способом, было бы таким, как показано на рис. 22.4, Б. При большом числе генов, действующих на один и тот же признак, ошибки измерения часто сопоставимы с различиями между классами, и дискретное наследование отдельных генов невозможно вылечить.
Третья особенность количественных признаков заключается в том, что они также подвержены влиянию модификационной изменчивости, результат которой непрерывен, т. е. он еще больше «смазывает» различия между классами. Все вместе это приводит к тому, что изменчивость по количественным признакам оказывается непрерывной.
Таким образом, наследование и изменчивость по количественным признакам нельзя изучать теми же методами, что и по качественным признакам. В последнем случае используют термины сильный и слабый ген (гены) в зависимости от их влияния на количественный признак. Между сильными и слабыми генами можно наблюдать промежуточные варианты проявлений. Кроме того, вследствие плейотропии один и тот же ген можно рассматривать как сильный по отношению к одним признакам и как слабый по отношению к другим. Изменчивость вследствие расщепления по многим генам называют полигенной, а обусловливающие ее слабые гены — полигенами.
Изучение
наследования количественных признаков
сопряжено с их измерениями, результаты
которых выражают в виде характеристик
получаемых распределений, таких, как
средняя арифметическая (![]() ),
среднее квардратическое отклонение
(σ),
варианса (σ2),
ошибка средней арифметической (S
)
и коэффициент изменчивости. Вычисление
этих величин подробно обсуждается в
курсах биометрии.
),
среднее квардратическое отклонение
(σ),
варианса (σ2),
ошибка средней арифметической (S
)
и коэффициент изменчивости. Вычисление
этих величин подробно обсуждается в
курсах биометрии.
Результатом действия факторов окружающей среды будет изменчивость количественных признаков, которую обозначают общим термином паратипическая. Учитывая, что паратипическая изменчивость в значительной степени обусловлена модификациями, необходимо знать, в какой мере их проявление зависит от генотипа. Для этого вычисляют коэффициент наследуемости признака, который показывает, какова доля генотипической изменчивости в наблюдаемых вариациях.
Коэффициент наследуемости (h2) вычисляют как частное от деления:
![]() где
σ2G—
варианса, зависящая от генотипического
разнообразия, a σ2P—
общая фенотипическая варианса,
складывающаяся из паратипической
вариансы σ2E
и
генотипической вариансы (σ2G)
для данной группы особей.
где
σ2G—
варианса, зависящая от генотипического
разнообразия, a σ2P—
общая фенотипическая варианса,
складывающаяся из паратипической
вариансы σ2E
и
генотипической вариансы (σ2G)
для данной группы особей.
3.Проблема стабильности генетического материала. Основные типы репарационных процессов на примере E. coli
Удивительная стабильность генетического материала — ДНК связана отнюдь не с ее консервативностью, а с существованием г» клетках всех живых организмов специальных систем репарации, устраняющих из ДНК возникающие в ней повреждения.
Явление репарации было открыто в 1958 г. В. И. Корогодиным у диплоидных дрожжей. Повреждения ДНК, возникающие при действии излучений и химических агентов, в конечном счете приводят к нарушению регулярной Уотсон-Криковской структуры, что выражается в локальной денатурации молекулы и приводят к частичному или полному блокированию репликации. Именно такие нарушения конформа- ции, а не конкретные изменения мономеров служат мишенью для большинства систем репарации ДНК.
 Рис. 6.17. Схема
механизмов репарации на примере
пострадиационного (УФ) восстановления
структуры ДНК (по P. Hanawalt, 1975, Е. Witkin,1976):
Рис. 6.17. Схема
механизмов репарации на примере
пострадиационного (УФ) восстановления
структуры ДНК (по P. Hanawalt, 1975, Е. Witkin,1976):
А — фотореактивация; Б — эксцизионная репарация; В — постреплика- тивная репарация
В настоящее время выявлены три основных механизма репарации ДНК: фото- реактивация, эксцизионная репарация и пострепликативная репарация (рис. 6.17). Последние два типа называют также темновой репарацией.
Фотореактивация
Явление фотореактивации заключается в восстановлении биологической активности клеток или молекул ДНК, поврежденных ультрафиолетовым излучением в результате последующего воздействия видимого света.
При фотореактивации происходит мономеризация циклобутановых димеров тимина и других пиримидиновых димеров in situ. Известна так называемая неферментативная коротковолновая фотореактивация, которая заключается в мономеризации димеров при действии ультрафиолетового света с длиной волны 240 нм, а также ферментативная фотореактивация. Именно последнюю обычно и подразумевают под собственно фотореактивацией.
Фотореактивация при действии видимого света (300—400 нм — наиболее активная часть спектра) была обнаружена в 1949 г. в нескольких лабораториях. Механизм этого явления был раскрыт в начале 60-х годов нашего века после выделения К. Рупертом из клеток микроорганизмов фермента фотореактивации — дезоксирибопиримидинфотолиазы. Экстракты дрожжей оказались способными восстанавливать трансформирующую активность ДНК Haemophyllus influenzae на свету.
Субстратом фермента фотореактивации служат димеры пиримидиновых оснований, с которыми он образует комплекс в темноте (с неповрежденной ДНК фермент не связывается). На свету комплекс распадается, при этом происходит мономеризация димеров. В клетке эукариот фермент локализован в ядре, у прокариот — в непосредственной близости к нуклеоиду. В частности, он не обнаруживается в безнуклеоидных миниклетках, которые образуют некоторые мутанты Е. coli.
Эксцизионная репарация
Эксцизионную репарацию, т. е. связанную с удалением поврежденного участка ДНК, называют также репарацией по типу выщепления — замещения или более образно «механизм режь — латай» (рис. 6.17). Эксцизионная репарация не столь специфична в отношении повреждений ДНК, как фотореактивация, тем не менее наиболее подробно изучена именно репарация ДНК, содержащей тиминовые димеры. Этому способствовало то обстоятельство, что возможность фотореактивации клеток — критерий присутствия тиминовых димеров в ДНК. Появление димеров приводит к локальной денатурации ДНК, что влечет за собой нарушение процесса репликации: каждый тиминовый димер в ДНК Е. coli задерживает репликацию на 10 с.
Доказательство существования и изучение механизма эксцизионной репарации стало возможным благодаря получению мутантов Е. coli, чувствительных к летальному действию ультрафиолетового света. Если штаммы Е. coli, устойчивые к ультрафиолетовому свету, инкубировать в темноте после облучения, то из их ДНК удаляются тиминовые димеры. У мутантов, чувствительных к ультрафиолетовому свету, этого не происходит.
Эксцизионная репарация представляет собой многоэтапный процесс и заключается в: 1) «узнавании» димера, 2) надрезании одной цепи ДНК вблизи димера — инцизии, 3) удалении димера — эксцизии, 4) ресинтезе ДНК и 5) восстановлении непрерывности репарируемой цепи за счет образования ковалентных связей сахарофосфатного скелета молекулы (рис. 6.17).
«Узнавание» повреждения в ДНК осуществляет фермент УФ- эндонуклеаза, который реагирует не только на димеры тимина, но и на многие другие изменения, приводящие к локальному нapyшению структуры ДНК. Эндонуклеаза ответственна и за инцизию, т. е. надрезание одной цепи ДНК (разрыв фосфодиэфирных связей) непосредственно около димера с 5'-конца в поврежденной цепи. Эксперименты in vitro с облученной ДНК показали, что число однонитевых разрывов оказывается равным числу димеров в молекуле.
Эксцизию, или вырезание димера из молекулы ДНК, осуществляет другая нуклеаза. Димер удаляется в составе короткого олигонуклеотида (3—5 оснований), что может сопровождаться дальнейшей деградацией поврежденной спирали. Продукты деградации облученной ДНК, содержащие тиминовые димеры, можно обнаружить в клетках. У некоторых бактерий димеры находили и в культуральной среде. Деградацию ДНК осуществляет АТФ- зависимая ДНКаза. В результате эксцизии и последующей деградации ДНК образуются однонитевые бреши, или пробелы.
Ресинтез ДНК, в результате которого заполняются бреши, идет с использованием в качестве матрицы интактной цепи. Такой репаративный синтез ДНК напоминает «дополнительную» репликацию, обнаруженную в пахитене у эукариот.
Основной фермент, ответственный за эксцизию димеров и репаративный синтез ДНК, — это ДНК-полимераза I, кодируемая геном pol А. Тем не менее у мутантов pol А, дефектных по ДНК- полимеразе I, все же наблюдается остаточный репаративный синтез, который связан с активностью ДНК-полимеразы II.
Известно, что неполуконсервативный синтез ДНК в 99% случаев происходит на коротких участках длиной до 30 нуклеотидов. За эту реакцию ответственна ДНК-полимераза I. В 1 % случаев синтез идет на гораздо более длинных отрезках — 1000—1500 нуклеотидов. По-видимому, эту реакцию и осуществляет ДНК-полимераза II.
Последний этап эксцизионной репарации заключается в восстановлении непрерывности репарируемой цепи ДНК с помощью фермента ДНК-лигазы, кодируемого геном lig Е. coli. Тем- пературочувствительные мутанты по этому гену не способны не только завершать процесс эксцизионной репарации в непермис- сивных условиях, но и накапливают фрагменты Оказаки при репликации ДНК.
Пострепликативная репарация
Этот тип репарации (см. рис. 6.17) был открыт в клетках мутантов Е. coli, не способных выщеплять тиминовые димеры. В таких клетках после ультрафиолетового облучения происходит репликация ДНК, хотя и медленнее, чем в клетках дикого типа. У. Рапп и П. Говард-Фландерс показали, что в клетках мутантов uvr А после действия ультрафиолетового света синтезируется ДНК с однонитевыми пробелами, или брешами, причем длина вновь синтезированных фрагментов соответствует среднему расстоянию между возникшими в родительской ДНК тиминовыми димерами. Таким образом, после репликации нерепарированной ДНК против тиминовых димеров образуются бреши, которые, как оказалось, исчезают при последующей инкубации клеток в питательной среде. Этот тип репарации не происходит в клетках гес-мутантов, дефектных по рекомбинации. Поэтому пострепликативную репарацию называют также рекомбинационной репарацией.
Механизм пострепликативной репарации наименее специфичен, так как здесь отсутствует этап узнавания повреждения. Представления об этом типе репарации связаны со знанием механизма рекомбинации Рекомбинационная пострепликативная репарация — это быстрый способ восстановления нативной структуры по крайней мере части дочерних молекул ДНК. При этом тиминовые димеры остаются в исходных родительских нитях. Эта репарация происходит уже в первые минуты после облучения.
SOS-репарация. Его характерная черта — неточность восстановления первичной структуры ДНК, в связи с чем она получил также название репарации, склонной к ошибкам. При этом, по мнению ряда авторов, возможен репаративный синтез ДНК «в обход» тиминовых димеров, или, точнее за счет использования в качестве матрицы цепи ДНК, содержащей димеры.
