
- •Від простих молекул до живих організмів
- •Клітина — основа структури живих систем
- •Люлози ко
- •Характеристика основних структурних компонентів клітини
- •Хімічний склад живих організмів
- •Хімічний склад білків
- •Характеристика амінокислот і
- •#_Сн-соон.
- •Класифікація амінокислот
- •Будова білків
- •Структура білків
- •Ступінь спіралізації', %
- •Фізико-хімічні властивості білків
- •Класифікація білків
- •Оксигемоглобін (Hh —02)
- •Розділ IV. Ферменти
- •Хімічна природа ферментів
- •Тіамінпірофосфат
- •Залпопорфіриінжий комплекс
- •Активний центр ферментів
- •Механізм дії ферментів
- •Ізоферменти
- •Активність ферментів
- •Номенклатура і класифікація ферментів
- •Характеристика окремих класів ферментів
- •1. Оксидоредуктази
- •Локалізація ферментів у клітині
- •Використання ферментів
- •Олігосахариди
- •Загальна характеристика і класифікація ліпідів
- •Класифікація і номенклатура вітамінів
- •Жиророзчинні вітаміни
- •Водорозчинні вітаміни
- •Рнбофлавінфосфат
- •Розділ VIII. Гормони загальна характеристика гормонів
- •Номенклатура і класифікація гормонів
- •Статеві гормони
- •Естран Єстрад'ол
- •Загальні уявлення про обмін речовин і енергії
- •Енергетичний баланс організму. Макроергічні сполуки
- •Біологічне окислення
- •Окислювальне фосфорилювання
- •Розділ X. Обмін білків
- •Всмоктування продуктів гідролізу білків
- •Обмін білків і амінокислот у тканинах
- •Перетворення амінокислот
- •Біосинтез білків
- •Молекулярні механізми специфічності біосинтезу білків. Генетичний код
- •Особливості генетичного коду
- •Генна інженерія і біосинтез білка
- •Регуляція синтезу білка
- •Розщеплення нуклеїнових кислот
- •Синтез нуклетнових кислот
- •Біологічна роль вуглеводів в організмі
- •Перетравлювання і всмоктування вуглеводів
- •Взаємоперетворення моносахаридів в організмі
- •Розкладання вуглеводів в організмі
- •Спиртове бродіння
- •Цикл трикарбонових кислот (цикл кребса)
- •Пентозний (апотомічний) цикл перетворення вуглеводів
- •Співвідношення між аеробним і анаеробним процесами перетворення вуглеводів в організмі
- •Біосинтез вуглеводів
- •Щавлево-оцтова кислота
- •Фосфоглюкомутази
- •Біологічна роль ліпідів в організмі
- •Перетравлювання і всмоктування ліпідів
- •Холанива кислота
- •Транспортні форми ліпідів
- •Біохімічна роль макроелементів
- •Характеристика і біологічна роль мікроелементів
- •Обмін солей
- •Взаємозв'язок між обміном вуглеводів і ліпідів
- •Метаболітний рівень регуляції
- •Організменний і популяційний рівні регуляції
- •Клітинний рівень регуляції
Структура білків
Для повного уявлення будови білків важливе значення має не тільки вивчення їх кількісного та якісного амінокислотного складу і способів зв'язку амінокислот в їх молекулах, а й цілого ряду інших питань. Особливо важливим є дослідження послідовності розміщення залишків амінокислот у поліпептидних ланцюгах, тобто первинної структури білка. Остання визначає тривимірну структуру поліпептидних ланцюгів, яка називається конформацією білка. Це термодинамічний, найбільш стійкий стан поліпептидних ланцюгів.
Про білки, які мають нормальну конформацію, кажуть, що вони перебувають у нашивному (природному) стані. Від конформації білкової молекули залежить її біологічна функція. Фактори, які впливають на природну конформацію білка, призводять до порушення його функції, яку виконує той чи інший білок в організмі.
Отже, згідно з сучасними уявленнями, у білках розрізняють чотири рівні структури — первинну, вторинну, третинну і четвертинну.
Первинна структура білків
І Іервинна структура білків — важлива їх характеристика, яка визначає властивості, функції, біологічну роль та просторову конфігурацію нагквннх білків. Під первинною структурою розуміють порядок розміщення або чергування залишків амінокислот в одному або кількох поліпептидних ланцюгах. Вона характеризується такими ознаками: природою амінокислот, які входять до складу молекули; кількістю амінокислот; порядком розміщення залишків амінокислот у поліпеп-тндному ланцюгу.
Первинна структура білка стабілізується пептидними (ковалентними! зв'язками.
Поліпептидний ланцюг з характерною для нього первинною структурою має N- і С-кінцеві амінокислоти. N-Кінпсвою амінокислотою називається амінокислота поліпептидного ланцюга з вільною аміногрупою, а С-кінцевою амінокислотою — з вільною карбоксильною групою. Нумерацію залишків амінокислот починають з N-кінцевої амінокислоти і закінчують С-кінцевою амінокислотою. Схематично поліпептидний ланцюг записують так:

Властивості і функції білків залежать не лише від кількісного та якісного складу мономерних ланок — амінокислот, а й від порядку розміщення їх, причому заміна чи перегрупування амінокислот у пер-
72
винній структурі викликає втрату певних функцій і відповідних біологічних властивостей. Це характерно і для низькомолекулярних пептидів. Дипептид аланіл-валін відрізняється властивостями від дипептиду валіл-аланін. Оскільки до складу білків входить 20 протеїноген-них амінокислот, то кількість ізомерів; які можуть утворитись за рахунок різних їх комбінацій, може досягти значних величин:
Кількість амінокислот
у молекулі 23456 7 8 10 20
Можлива кількість ізо мерів 2 6 24 120 720 5040 40 320 336 278 2-Ю14
Однак у білках, як правило, не реалізуються всі потенційно можливі комбінації амінокислот, що входять до їх складу. На основі дослідження порядку чергування амінокислот у складі поліпептидних ланцюгів білків були встановлені закономірності, характерні для первинної структури, які стосуються її будови та складу. Незважаючи на значну різноманітність білків, існує певна подібність їх в амінокислотному складі/ Для переважної більшості білків характерним є наявність у складі молекул великої кількості залишків гліцину, валіну, аспарагінової та глутамі нової кислот, незначної кількості залишків триптофану, гістидину, метіоніну, аргініну. Деякі білки (гі-стони, протаміни, протеїноїди) мають специфічний амінокислотний склад, в яких переважають певні амінокислоти (аргінін — у гістонах і гідрокси пролін — у протеїноїдах).
У білках відсутня певна загальна закономірність чергування залишків амінокислот, яка була б характерна для всіх білків. Вісімнадцять амінокислот і два аміди, що входять до складу білків, багаторазово повторюються в складі білкових молекул, причому в різних білках співвідношення між ними неоднакове. Проте встановлено, що в поліпептидних ланцюгах білків, а також на різних ділянках одього і того самого пол і пептидного ланцюга зустрічаються фрагменти (ди-, три-, тетра-пептиди) однакові або подібні за порядком чергування амінокислот, тобто для первинної структури білків характерним є принцип структурної подібності.
Особлива роль у реалізації даного принципу належить трипептид-ним угрупованням. Так, у 52 рибосомних білках тотожні трипептидні блоки повторюються 657 разів, тстрапептидні — 86, пентапептидні — 11 разів. Навіть у первинній структурі білків, що викопують різні біологічні функції в організмі, можуть зустрічатися невеликі ідентичні ділянки молекул. Наприклад, у молекулі гормону інсуліну і ферменту рибонуклеази на ділянках поліпептидних ланцюгів зустрічаються три однакових трипептиди і один тетрапептид (табл. 6). Первинна структура білків може мати до 50 % тотожних пептидних фрагментів.
У первинній структурі білків реалізується також принцип взасмо-замінності амінокислот. Взаємозамінними є амінокислоти, що містять
73
Таблиця 6. Структурна подібність інсуліну і рибонуклеази
|
|
Інсулін |
|
|
|
Угруповання пептидів |
Ланцюг А |
|
|
Ланцюг В |
Рибонуклеаза |
Ала — сер — вал Ала — сер — вал
8 9 10 122 123 124
Вал |
— цис - |
- сер |
|
|
Вал- |
- цис - |
- сер |
10 |
11 |
12 |
|
|
57 |
58 |
59 |
|
|
Вал— |
глу- |
- ала |
Вал - |
- глу |
— ала |
|
|
12 |
13 |
14 |
54 |
55 |
56 |
Ідентичні тетрапеп- Аси —тир —дис — аси Аси—тир—цис—асн
тиди 18 19 20 21 24 25 20 27
радикали, подібні за структурою та властивостями, зокрема гліцин — серии, лейцин — ізолейцин, лейцин — валін, глутамінова кислота — аспарагінова кислота. Амінокислоти з полярними радикалами не можуть замінити в складі поліпептидного ланцюга амінокислот з неполярними радикалами, тобто без втрати білком характерних біологічних функцій.
Порядок розміщення амінокислот у білках та їхня просторова структура і біологічні властивості закріплені генетично і пристосовані до виконання певних функцій, тому виділені з різних організмів білки, що характеризуються однаковими функціями, мають подібність у первинній структурі. Наприклад, у цитохромі с послідовність амінокислот у поліпептидпому ланцюгу визначили для 38 видів організмів (від дріжджів до приматів). Було виявлено, що 35 залишків амінокислот з 104 в усіх видів однакові, причому 11 із 35 утворюють безперервний фрагмент, ідентичний в усіх молекулах, 23 залишки в молекулах із різних джерел — це заміна досить близькими амінокислотами як за будовою, так і за властивостями. Білки, що подібні за первинною структурою і виконують у різних видів організмів одні і ті самі функції, називаються гомологічними.
Дослідження первинної структури гомологічних білків, виділених з різних видів живих організмів, є важливим критерієм таксономії. Крім того, було встановлено, що ступінь подібності послідовностей амінокислот знаходиться у прямій залежності від філогенетичної спорідненості. Цитохроми вищих тварин і дріжджів відрізняються між собою AS амінокислотними залишками, а цитохром с людини і приматів — лише одним.
Відмінність у первинній структурі білків, що виконують однакові функції в різних видів живих організмів, називається видовою
74
Таблиця 7. Заміна амінокислот у поліпептидних ланцюгах А молекул інсуліну людини і тварин
Об'єкт |
Послідовність залишків амінокислот в ланцюгу А |
Об'єкт дослідження |
Послідовність залишків амінокислот в ланцюгу А |
||||
дослідження |
8 |
9 |
10 |
8 |
9 |
10 |
|
Людина |
Тре |
Сер |
Іле |
Сейвал |
Ала |
Сер |
Тре |
Бик |
Ала |
Сер |
Вал |
Собака |
Тре |
Сер |
Іле |
Баран |
Ала |
Глі |
Вал |
Кріль |
Тре |
Сер |
Іле |
Кінь |
Тре |
Глі |
Іле |
Свиня |
Тре |
Сер |
Іле |
Кашалот |
Тре |
Сер |
Іле |
|
|
|
|
специфічністю білків. Так, інсулін різних видів тварин і людини складається з 51 амінокислотного залишку. Ланцюг В в усіх видів тварин ідентичний, відмінність за амінокислотним складом характерна для ланцюга А і стосується залишків амінокислот, що знаходяться в положеннях 4, 8, 9, 10, 13, 14, 15, 18. Інші амінокислотні залишки ідентичні в усіх видів тварин. Залишки амінокислот, за якими відрізняються білки з однаковими функціями у різних видів тварин, називаються варіабельними (табл. 7).
Гемоглобін А (нормальний)
Гемоглобін S (серповидний)
Слід зазначити, що відмінність первинної структури певних білків є характерною і для особин одного виду. Такий поліморфізм є результатом мутацій, які передаються за спадковістю. Мутації, що спричиняють порушення функцій білка, бувають причиною різних захворювань (так звані молекулярні хвороби). Відомо, що гемоглобін здорової людини і людини, хворої на спадкове захворювання (серповидно-клітинну анемію), відрізняється лише тим, що залишок глутамінової кислоти в шостому положенні біля N-кінця р-поліпептидного ланцюга замінений на залишок валіну:
Глу — Ліз
Вал — Гіс — Лей — Тре — Про — | Глу Вал — Гіс — Лей — Тре — Про
Вал | — Глу — Ліз
Нині вивчено понад 100 аномальних гемоглобінів і майже в усіх випадках причиною аномальності є заміна одного чи кількох залишків амінокислот в а- або р-поліпептидному ланцюгу:
Гемоглобін
С D Е G Q
Заміна (положення)
Глу —Ліз (р6) Глу -+■ Глн (рш) Глу -*■ Ліз (р26) Аси—Ліз ґа68) Асп —Гіс-<а75)
75
Характерним є те, що виявлені в аномальних гемоглобінах заміни найчастіше стосуються гідрофільних амінокислот. Вивчення первинної структури значної кількості білків дало змогу з'ясувати на молекулярному рівні причини виникнення багатьох спадкових захворювань.
Нині незаперечним є твердження про те, що первинна структура білків значною мірою визначає вищі рівні їхньої структури, зокрема конформацію- Доказом цього є хімічний синтез ферменту рибонуклеази, здійснений Мерріфільдом. Синтезований поліпептид з первинною структурою, ідентичною нативному ферменту, мав таку саму біологічну активність, як і нативний білок. Це свідчить про те, що фермент, добутий методом хімічного синтезу,«набув тривимірної конформації (від якої залежить ферментативна активність) виключно на основі первинної структури — послідовності 124 залишків амінокислот, розмішених у певному порядку.
Першим білком, в ролі пептидному ланцюгу якого детально вивчили якісний і кількісний склад та послідовність розміщення залишків амінокислот, був гормон інсулін. За ці дослідження англійському біохіміку Ф. Сенгеру в 1958 р. було присуджено Нобелівську премію.
Інсулін — найбільш низькомолекулярний білок (6000). До складу молекули входить 51 залишок шістнадцяти різних амінокислот. Молекула інсуліну складається з двох поліпептидних ланцюгів, сполучених дисульфідними зв'язками. Ланцюг А містить 21, а ланцюг В — ЗО залишків амінокислот (рис. 13). Синтезується інсулін у підшлунковій залозі ^-клітинами у вигляді попередника проінсуліну, який містить у складі молекули 84 залишки амінокислот. Перетворення проінсуліну на активний гормон відбувається після часткового протеолізу молекули — відщеплення від її С-кінця фрагмента з 33 залишків амінокислот (С-пептиду). Біологічна роль інсуліну — регуляція вуглеводного обміну шляхом впливу па проникність мембран та активність ферментів.
Пізніше було розшифровано первинну структуру білка ферменту рибонукіеази, що має в складі молекули 124 залишки амінокі (р-ис. 14), аспартат-амінотрансферази (412), fi- і р'-субодиннць ферменту ДНК-залежної РНК-полімерази, до складу молекул яких входить відповідно 1342 і 1407 залишків амінокислот, зорового пурпуру, нейро-токсинів, лактогенного гормону, пепсину, трипсину, хімотрипсипу альдолази, лізоциму, папаїпу, гемоглобіну, цитохрому с та багатьох інших білків (див. рис. 14).
Методи вивчення первинної структури. Враховуючи високу інформативність первинної структури та її роль у забезпеченні фізико-хі-мічних та біологічних властивостей білків, важливим с вивчення топографії певних ділянок молекул, дослідження якісного і кількісного складу амінокислот та порядку розміщення їх в одному чи кількох поліпептидних ланцюгах.
76
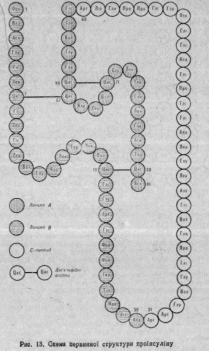

Рис. 14. Первинна структура цитохрому с
Дослідження первинної структури білків пов'язане з певними труднощами, оскільки більшість білків мають досить високу молекулярну масу та складну структуру. Значних успіхів у з'ясуванні первинної структури білків було досягнуто в лабораторіях А. Е. Брауниїтейна і Ю. А. Овчинникова починаючи з 70-х років XX ст..завдяки вдосконаленню методів біохімічних досліджень, автоматизації та комп'ютеризації їх основних етапів. Важливим етапом стало застосування автоматичних аналізаторів (секвенаторів), за допомогою яких стало можливим дослідження первинної структури високомолскулярних білків за досить короткий відрізок часу, використовуючи иікомольні (10-12) концентрації зразка. Так, було встановлено первинну структуру великої групи білків, які мають важливі фізіологічні функції. Тріумфом у вивченні первинної структури стало з'ясування порядку чергування амінокислот у молекулі білка імуноглобуліну, який містить понад 1300 залишків амінокислот. Нині розшифровано первинну структуру понад 2000 білків. По мірі з'ясування первинної структури дані nepe-
rs
даються на ЕВМ (банк даних), в зв'язкуз чим виникає можливість пошуків ступегя спорідненості (гомології) між первинною структурою білків та послідовністю нуклеоткдів у ДНК, виявлення особливостей розвитку організмів, філогенетичних взаємовідносин та окремих еволюційних процесів.
Вивчення первинної структури білків складається з таких послідов-шіх етапів.
Визначення числа протомерів у складі молекули. Для цього визначають молекулярну масу та кількість груп NH2.
Руйнування четвертинної структури (дисоціація інтактних агрегатів) з меіою одержання індивідуальних поліпептидних ланцюгів.
Визначення числа і природи простетичиих груп.
4. Визначення наявності внутрішньоланцюгових та міжланцюго- вих дисульфідних зв'язків.
Ь. Розщеплення поліпептидних ланцюгів на більш короткі фрагменти.
Визначення порядку чергування амінокислот в отриманих фрагментах (секвенація).
Відтворення первинної структури білка та визначення порядку розміщення пептидів в білковій молекулі.
Оскільки четвертинна структура стабілізується силами слабкої взаємодії, зруйнувати ЇЇ нескладно. Дисоціація нативпої молекули па субодиниці досягається за допомогою простих методів — обробки поверхнево-активними речовинами, зміною рН, слабким нагріванням розчину тощо.
Дисульфідні зв'язки, які стабілізують третинну структуру, руйнуються під час їх окислення або відновлення. Окислення дисульфідних зв'язків здійснюють надмурашиною кислотою, внаслідок чого утворюються похідні цистеїнові кислоти;

Недоліком даного методу є те, що в процесі окислення руйнується амінокислота триптофан.
Для відновлення дисульфідних зв'язків використовують меркап-тоетанол:
R
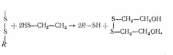
79
Утворені реакційно-здатні, сульфгідрильні групи блокують акрилонітрилом або йоданетатом:
R—SH + СІ І2 = CH-C«tf -* /?_S—CH2—CHS—CssN.
Після руйнування третинної структури та утворення вільних поліпептидиих ланцюгів здійснюють кислотний гідроліз білків протягом 12—36 год при 100—ПО °С або селективний гідроліз за участю специфічних хімічних реагентів та протеолітичних ферментів. Кислотний гідроліз використовується обмежено, оскільки при цьому руйнуються триптофан та аміди аспарагінової і глутамінової кислот.
Протеолітичні ферменти, які застосовують для селективного гідролізу, попередньо іммобілізують (зв'язують) з нерозчинним носієм, щоб полегшити відокремлення ферментів від продуктів гідролізу- Се-лектиьність (вибірковість) дії протеолітичних ферментів полягає в тому, що кожен фермент розщеплює в складі білкових молекул лише пептидні зв'язки, які утворені певними залишками амінокислот. Так, трипсин гідролізує пептидні зв'язки, утворені карбоксильними групами лізину й аргініну, хімотрипсин — зв'язки, утворені карбоксильними групами ароматичних амінокислот, пепсин — ароматичними і ди-карбоновими.
Із хімічних реагентів для селективного гідролізу використовують бромціан (гідролізує пептидні зв'язки за місцем карбонільної групи залишків метіоніну), 2,4-динпрофторбензол (за місцем карбонільної групи цистеїну) або N-бромсукцинамід (за місцем карбонільної групи цистеїну) або N-бромсукцииамід (за місцем карбонільної групи триптофану). В результаті селективного гідролізу утворюється суміш пептидів з невеликою молекулярною масою. Для фракціонування неп-тидів і встановлення послідовності амінокислот використовують високовольтний електрофорез, хроматографію або метод пептидиих карт. Суть останнього методу пилиіає в тому, Що під вплиЕОМлеацих реа-гентів утворюється набір пептидів меншого розміру, які розділяють методом хроматографії або електрофорезу, потім визначають первинну структуру кожного пептиду, виявляють чергування залишків амінокислот, що перекриваються, і визначають первинну структуру білка.
Важливим етапом під час дослідження первинної структури білків є визначення локалізації дисульфідних зв'язків. Для цього перед проведенням селективного гідролізу в білках модифікують усі групи SH. Пептиди, що містять окислені сульфгідрильні групи, виділяють і обробляють реагентами, які розривають дисульфідні зв'язки. Утворені пептиди розділяють і визначають порядок чергування амінокислот.
Секвеиація пептидів починається з визначення кінцевих амінокислот у поліпептидному ланцюгу.
Для визначення N- і С-кінцевих амінокислот є багато різних методів. Один з них, який почали використовувати для визначення N-кін-
80
цевих амінокислот,— це динітрофенільнпй метод. Його розробив англійський біохімік Ф. _Сенгер і застосував для вивчення первинної структури білка інсуліну. Суть методу полягає" в тому, що на білок у слабколужному середовищі діють 2,4-динітрофторбепзолом, який реагує з N-кінцевою амінокислотою пептидного ланцюга. При цьому утворюється динпрсфенільне похідне — ДНФ-похідне білка (пептиду):
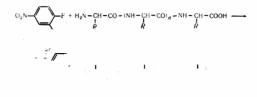
N0;
2,4 Динітрофторбензол Пептидний ланцюг
»07*-\ \-NH-:H-CO-(NH-CH-CO)fl-NH-CH-COOM * HP
^=< R R R
NO,
ДНФ-похідне білка (пептиду)
Далі в результаті кислотного гідролізу (6 н. розчин НСІ) динітро-фенільного похідного білка (пептиду) усі пептидні зв'язки розриваються, крім зв'язку, утвореного 2,4-динітрофенільною групою і а-аміногрупою N-кінцевої амінокислоти. За цих умов утворюються вільні амінокислоти і динітрофенільне похідне N-кінцевої амінокислоти:

°'N \ / NH_CH~CO"(NH"'CH~CO)fl-NH-CH-COOH + («>|)Н»0 -
^Ч /? R R
N0,
ДНФ-похідне N-кінцевої 0
амінокислоти Вільн|амінокислоти
Потім за допомогою відповідних методів (хроматографії, електрофорезу, колориметрії, спектрофотометрії) здійснюють якісний і кількісний аналізи л-кінцевих амінокислот. Більш чутливим методом, ніж динітрофенільнпй, є^^іісліліШій-44«тед-визііачення N-кінцевих амінокислот. Суть цього методу полягає в тому, що N-кінцєва амінокислота пептиду в лужному середовищі взаємодіє з 1-диметпламіпонафтил-5-сульфонілхлоридом (дансилом). При цьому утворюється диметиламін-
Si
нафтилсульфоніл-білок (ДНС-білок):
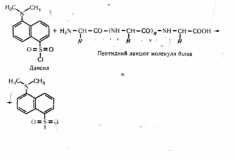
' ' ■ і
R К R
ДНС-білох
Далі здійснюють кислотний гідроліз ДНС-білка 20 %-м розчином НС1, що приводить до утворення вільних амінокислот і N-кінцевої амінокислоти у вигляді ДНС-похідного:

82
Після цього ДНС-амінокислоту, завдяки інтенсивній флуоресценції дансильних груп, виявляють і кількісно визначають.
Для визначення N-кінцевих амінокислот зараз широко використовують фентлтюгідантоїновин метод, розроблений С-- F"M;i"nM £^уи методу полягає в тому, що на білок (пептид) діють фенілізотіоціанатом, що приводить до утворення фенілтіокарбамільного похідного (ФТК-похідного білка — пептиду):


Потім на ФТК-похідне діють розчином соляної кислоти, розчиненої в органічних розчинниках. При цьому відбувається циклізація і відщеплення N-кінцевої амінокислоти у вигляді фенілтіогідантоїну:
С,Н5—NH CO—NH-CH-CO(-NH-CH-CO)n-NH-CH-COOH—->
С CHR R R R
S NH
->C,H5-N-CO + JI2N -CH—CO(-NH-CH-CO)„-NH—CH-COOH.
Ill I I
С СНУ? R R R
: NH Білок або пептид, укорочений на один
Фенілтіогідантоїн
Для ідентифікації фенілтіогідантоїну використовують хроматографію — тонкошарову, газорідинну тощо.
Основна перевага метолу Рдмана, порівняно з іншими методами, полягає в тому, що пептидний ланцюг, укорочений на одну амінокислоту, можна виділити непошкодженим і знову обробити його фенілізотіоціанатом, після чого знову утворюється фенілтіогідантоїн, у складі якого буде наступна N-кінцева амінокислота. Внаслідок багатьох * повторень цього процесу можна вивчити послідовність розміщення залишків амінокислот у пептидному ланцюзі молекули білка.
На основі методу Едмана сконструйовано автоматичний прилад для визначення послідовності амінокислот у поліпептидах, які містять велику кількість залишків амінокислот.
Для шщачення N-кінцевих залишків амінокислот крім хімічних методів застосовують і ферментативний метод. З цією метою використовують фермент з групи екзопептидаз — лейцинаміноиептидазу, яка діє на пептид при наявності в N-кінцевій амінокислоті вільної
ва
амінокислоти. Відщеплення однієї N-кінцевої амінокислоти зумовлює появу в пептидному ланцюзі нового залишку N-кінцевої амінокислоти.
Вивчення кінетики відщеплення амінокислот від поліпептиду дає певну інформацію про послідовність їх у ланцюгу.

Д«*я вивчен4Ш-С--КІнцевц.х амінокислот часто використовують метод гідразиволізу, розроблений японським ученим Ф. АкабборІ, який грунтується на гідролізі поліпептидного ланцюга молекули білка гідрози-ном. При цьому С-кінцева амінокислота відщеплюється у вільному стані, а всі інші амінокислоти — у вигляді сполук з гідразином, які називають гідразидами:
НЛ-СН-СО- і\Н-СН-СО)„-\Н-бі-СООН <іп MJH/N-NH, *
R R R
Поліпептидний ланцюг молекули білка Плразии
► H^N-CH-COOH + In +l)H;N-CH-CO-NH-NH,
R R
С-Кіниева амінокислота Гідразиди амінокислот
Гідролізат потім обробляють 2,4-динітрофторбензолом, в результаті чого гідразиди перетворюються на ДНФ-гідразиди амінокислот (в), а С-кінцева амінокислота — на ДНФ-амінокнслоту (б):
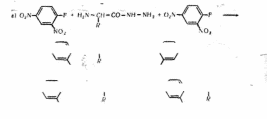
* 0,N-/ V-_NH-CM-CO-\H-\H-/ V-\(), + 2HF.
NO; 0;N
ДНФ-пдрааид 6)0i\~/ V-F ♦ H,N-CH-COOH *Otti-f V\H-CH-COOH + HF
SO j NO,
ДНФ-амінокислота
Після цього ДНФ-гідразиди екстракцією (оцтово-етнловим ефіром) відділяють від ДНФ-амінокислот. Останні якісно і кількісно ідентифікують, використовуючи для цього відповідні біохімічні методи.
Для визначення С-кінцевих амінокислот застосовують також ферментативний метод, використовуючи панкреатичні карбоксипептида-зи. Так, карбокснпептидаза А відщеплює від білка або пептиду лише той залишок амінокислоти, який має вільну карбоксильну групу.
Інформацію про послідовність С-кінцевих амінокислот у ланцюгу можна дістати під час визначення швидкості відщеплення кожного наступного залишку амінокислоти. Треба зазначити, що карбоксипепти-даза А малоактивна або зовсім неактивна до залишків С-кінцевих амінокислот лізину, аргініну і проліну. Тому залишки амінокислот лізину та аргініну з вільною карбоксильною групою легко відщеплюються за участю ферменту карбоксипептидази В.
Нині первинну структуру білків можна встановити також за будовою кодуючого його гена — чергування нуклеозидмонофосфатів на структурі ДНК.
Вторинна структура білків
Вторинна структура білка — це просторова конфігурація окремих ділянок поліпептидного ланцюга, його орієнтація та спосіб укладання в просторі.
Розрізняють такі види просторової конфігурації поліпептидних ланцюгів, які характеризують вторинну структуру,— спіральна, пошарово-складчаста та статичний клубок. Спіральна конфігурація представлена такою о пор я дкованою структурою, як а-спіраль, а пошарово-складчаста — р-структурою, крос-р-формою та р-вигином. Статичний клубок утворює невпорядковані безструктурні або аморфні ділянки поліпептидного ланцюга.
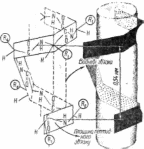
Спіральна структура. Модель просторової конфігурації поліпептидного ланцюга у вигляді се-спіралі вперше запропонували Л. Полінг і Р. Корі в 1951 р. на "основі даних рентгеноструктуриого аналізу білків і пептидів (рис. 15). Такий вигляд спіралі виявився найбільш ймовірним з урахуванням обмежень, зумовлених геометрією пептидних зв'язків, довжиною міжатомних відстаней, значенням тор-сійпих кутів повороту та інших особливостей, характерних для пептидних угруповань. Спіральна структура утворюється, як правило, тоді, коли в усіх ланках поліпептидного ланцюга кути повороту навколо рис. 16. Модель «-спіралі
с 5
простих зв'язків близькі до 60 або 45е. Це приводить до поступового закручування поліпептидного ланцюга та утворення а-спіралі. Згідно з розрахунками Л. Полінга і Р. Корі, а-спіраль є найоптимальнішою в енергетичному відношенні, оскільки має найменший рівень вільної енергії. Стабілізується а-спіраль внутрішньомолекулярними водневими зв'язками, які виникають між воднем іміногрупи та киснем карбонільної групи пептидних угруповань oefpny поліпептидного ланцюга.
Усі водневі зв'язки, які стабілізують а-спіраль, приблизно паралельні до осі спіралі і колінеарні один одному, що відповідає мінімуму вільної енергії. Кожна карбонільна група утворює водневі зв'язки з четвертою по ходу ланцюга імінною групою, тобто утворюється 5 ->- 1 зв'язок з 13-членним циклом. Утворення водневих зв'язків усере:шиі ланцюгів є наслідком mpawc-орієнтації копланарного пептидного угруповання.
Радикали залишків амінокислот розміщуються на периферичних ділянках утвореного а-епіраллю уявного циліндра по різні боки від осі спіралі. Кислотно-основні властивості радикалів можуть забезпечувати гідрофобну або гідрофільну природу окремих ділянок поверхні а-спіральної структури.
Велика кількість неполярних радикалів, згрупованих на одному боці а-спіралі, утворює так звані гідрофобні кластери, або дуги, які можуть створювати умови для зближення окремих а-спіральних ділянок. Це має певне значення при формуванні надвторинних структур.
Радикали амінокислот помітно впливають на утворення і стабілізацію а-спіралг. Так, проведені дослідження з поліаланіном, радикали якого за величиною незначні і не мають заряду, свідчать про те, що він самовільно утворює а-спіральну структуру у водному розчині при рН = 7,0. Поліпептид на основі іншої амінокислоти — лізину, тобто полілізин, при цьому самому значенні рН а-спіралі не утворює, а має вигляд невпорядкованого клубка. У нейтральному середовищі радикали лізину мають позитивний заряд, що перешкоджає їм зближуватися, оскільки діють сили відштовхування, причому ці сили переважають сили, я*і необхідні для утворення внутрішньоланцюгових водневих зв'язків. Подібні експерименти було проведено з поліаміно-кислотами. Це дало змогу встановити, що деякі амінокислоти (аланін, валін, лейцин, метіонін, фенілаланін, тирозин, триптофан, гістидин тощо) сприяють утворенню а-спіралі, особливо коли вони розміщені поряд у поліпептидному ланцюгу. Тнші амінокислоти, такі як лізин, аргінін, гліцин, серин, треонін, аспарагінова і глутамінова кислоти сприяють дестабілізації а-спіралі. Разом з цим окремі амінокислоти, зокрема пролін і оксипролін, просторово в спіральну структуру не вкладаються. На цих ділянках напрям поліпептидного ланцюга змінюється на 103°, і спіральна структура порушується.
Наведені вище дані свідчать проте, що поліпептизні ланцюги у молекулах білка спіралізовані не повністю. Для кожного білка харак-
86
Таблиця 8. Ступінь спіралізації поліпептидних ланцюгів (за Девісом, 19С5)
Білок
