
- •Від простих молекул до живих організмів
- •Клітина — основа структури живих систем
- •Люлози ко
- •Характеристика основних структурних компонентів клітини
- •Хімічний склад живих організмів
- •Хімічний склад білків
- •Характеристика амінокислот і
- •#_Сн-соон.
- •Класифікація амінокислот
- •Будова білків
- •Структура білків
- •Ступінь спіралізації', %
- •Фізико-хімічні властивості білків
- •Класифікація білків
- •Оксигемоглобін (Hh —02)
- •Розділ IV. Ферменти
- •Хімічна природа ферментів
- •Тіамінпірофосфат
- •Залпопорфіриінжий комплекс
- •Активний центр ферментів
- •Механізм дії ферментів
- •Ізоферменти
- •Активність ферментів
- •Номенклатура і класифікація ферментів
- •Характеристика окремих класів ферментів
- •1. Оксидоредуктази
- •Локалізація ферментів у клітині
- •Використання ферментів
- •Олігосахариди
- •Загальна характеристика і класифікація ліпідів
- •Класифікація і номенклатура вітамінів
- •Жиророзчинні вітаміни
- •Водорозчинні вітаміни
- •Рнбофлавінфосфат
- •Розділ VIII. Гормони загальна характеристика гормонів
- •Номенклатура і класифікація гормонів
- •Статеві гормони
- •Естран Єстрад'ол
- •Загальні уявлення про обмін речовин і енергії
- •Енергетичний баланс організму. Макроергічні сполуки
- •Біологічне окислення
- •Окислювальне фосфорилювання
- •Розділ X. Обмін білків
- •Всмоктування продуктів гідролізу білків
- •Обмін білків і амінокислот у тканинах
- •Перетворення амінокислот
- •Біосинтез білків
- •Молекулярні механізми специфічності біосинтезу білків. Генетичний код
- •Особливості генетичного коду
- •Генна інженерія і біосинтез білка
- •Регуляція синтезу білка
- •Розщеплення нуклеїнових кислот
- •Синтез нуклетнових кислот
- •Біологічна роль вуглеводів в організмі
- •Перетравлювання і всмоктування вуглеводів
- •Взаємоперетворення моносахаридів в організмі
- •Розкладання вуглеводів в організмі
- •Спиртове бродіння
- •Цикл трикарбонових кислот (цикл кребса)
- •Пентозний (апотомічний) цикл перетворення вуглеводів
- •Співвідношення між аеробним і анаеробним процесами перетворення вуглеводів в організмі
- •Біосинтез вуглеводів
- •Щавлево-оцтова кислота
- •Фосфоглюкомутази
- •Біологічна роль ліпідів в організмі
- •Перетравлювання і всмоктування ліпідів
- •Холанива кислота
- •Транспортні форми ліпідів
- •Біохімічна роль макроелементів
- •Характеристика і біологічна роль мікроелементів
- •Обмін солей
- •Взаємозв'язок між обміном вуглеводів і ліпідів
- •Метаболітний рівень регуляції
- •Організменний і популяційний рівні регуляції
- •Клітинний рівень регуляції
Біологічне окислення
Вивчення процесів окислення було започатковано М. В. Ломоно-совим та А. Лавуазье на основі дослідження продуктів згоряння. А. Лавуазье, співставлюючи процеси горіння з процесами дихання в живих організмах, звернув увагу на подібність між ними.
При диханні, як і при згорянні, відбувається поглинання кисню та утворення С02 і Н20. Енергетичний ефект окислення органічних сполук в організмі та згоряння їх також виявились тотожними. Так, при окисленні глюкози до кінцевих продуктів і при згорянні її в колориметрі виділяється однакова кількість енергії 2881 кДж/моль. У зв'язку з цим А. Лавуазье висловив припущення, що сполуки в організмі окислюються в результаті їх повільного згоряння. Не зрозумілим було лише те, чому «горіння» різних сполук в організмі відбувається при низькій температурі, без полум'я і за наявності води.
Перші спроби з'ясувати особливості та механізм окислення сполук в організмі (біологічного окислення) зробив Ф. Шенбайн, який висловив припущення, що біологічне окислення — це каталітичний процес, необхідною умовою перебігу якого є активація кисню.
На початку XX ст. О. Н. Бах та К. Енглер одночасно і незалежно один від одного запропонували гіпотезу, згідно з якою біологічне окислення прр_хддить за рахунок активування кисню і першим етапом Даного процесу є ^творення пёроксидних сполук. Активування кисню"
333
здійснюється за рахунок енергії сполук, здатних до самоокислення, та ферментів оксидаз. Такими сполуками є каротини, терпени, ноліенові вищі жирні кислоти, в молекулах яких є кратні подвійні зв'язки, внаслідок чого вони легко взаємодіють з молекулярним киснем, утворюючи пероксидні сполуки, які розщеплюються за участю ферментів пероксид; з і утворюють активний кисень. Останній окислює молекули інших органічних сполук, які з молекулярним киснем не реагують:

R-CH^CH-R,
+ 02
•Шп00КСигЄна3^
R-CH-CH-R,;
. І І О—О
R-CH-CH-R,
п*Р°КСИДаз£
Я-СН-СН-^ + О';
II \ /
О—О О
^^.Окс^а^^^.^^
Оскільки окислення проходить через утворення пероксидних сполук, то теорія О. М. Баха дістала назву пероксидної теорії окислення.
Значний внесок у розуміння процесів біологічного окислення зробив російський біохімік В. І. Палладій. Вивчаючи окислення речовин у рослинах, він встановив, що воно може відбуватися і при відсутності кисню, якщо в реакційному середовищі є речовини, які здатні приєднувати водень. Такими речовинами виявились пігменти — хромогени. Приєднуючи водень від субстратів, які окислюються, вони відновлюються і стають безбарвними. Потім — віддають водень, тобто окислюються, знову набувають забарвлення, перетворюючись на хінони. Перетворення проходить за участю кисню повітря:

Гідрохінон
І підновлена форма %і»ону|
Чінои
О
334
Слід зазначити, що В. І. Палладій надавав великого значення кисню як акцептора водню і цим самим показав важливу роль кисню в процесах біологічного окислення. Дослідження В. І. Палладіна були підтверджені працями Віланда. Він висловив думку, що дегідрування субстратів є основним процесом, який лежить в основі біологічного окислення, і що кисень взаємодіє вже з активованими атомами водню. Отже, була створена теорія окислення речовин шляхом їх дегідрування, яка дістала назву теорії Палладіна — Віланда.
Основою в підтвердженні даної теорії було викриття і вивчення цілого ряду дегідрогеназ —ферментів, які каталізують відщеплення атомів водню від різних субстратів. Було доведено, що процеси окислення субстратів — ие цілий ланцюг послідовних реакцій, які починаються з дегідрування субстратів і закінчуються перенесенням електронів на кисень та взаємодією останнього з протонами водню з утворенням води. Оскільки при такому окисленні постійно має місце поглинання кисню, то його ще називають тканинним диханням.
Отже, на основі вищенаведених теорій і досліджень створено сучасні уявлення про механізм біологічного окислення, в основі якого лежить пероксидна теорія Баха і теорія Палладіна — Віланда про дегідрування субстратів.
Сучасні уявлення про біологічне окислення
Біологічне окислення, яке проходить в організмах людини і тварин, є досить складним процесом. У ньому беруть участь десятки і сотні різних ферментів, внаслідок чого потенціальна енергія, яка міститься в молекулах органічних сполук, вивільнюється і використовується в самих різноманітних процесах життєдіяльності організму.
Процес біологічного окислення проходить поетапно. У ньому беруть участь ферментні системи, які містять у вигляді небілкової частини НАД', НАДФ+.ФМН, ФАД, убіхінони ізалізопорфіринові комплекси.
На першому етапі біологічного окислення здійснюється дегідрування субстратів — продуктів розщеплення білків, жирів і вуглеводів. Цей процес відбувається за участю ферментів дегідрогеназ (окси-доредуктаз), які містять коферменти НАД+ і НАДФ-^ Вони є майже універсальними акцепторами водню для багатьох субстратів — спиртів, альдегідів, дикарбонових і кетокислот, амінів тощо. Віднімаючи від субстратів атоми водню (електрони і протони), вони самі відновлюються, а субстрати при цьому окислюються (див. с 336).
Як видно з рівняння, функціональною групою дегідрогеназ є амід нікотинової кислоти. Атоми водню, що відщеплюються віл субстрату, приєднуються до вуглецю в положенні 4 нікотинамідного кільця. Електрон другого атома водню субстрату приєднується до азоту в положенні І, компенсуючи^його позитивний заряд, а протон переходить у розчин.
335

0 Прикладом дегідрогеназ може бути лактатдегідрогеназа, яка каталізує реакцію дегідрування молочної кислоти:
СН3—СН—СООН
+НАД+->
СН3—CO—СООН
+
НАД
.
Н
+
Н+.

Стід зазначити, що специфічність дії цієї групи дегідрогеназ зумовлена білковою частиною ферменту, оскільки коферменти схожі за своєю будовою.

Q .»• +
НАД-Н+Н*
ФМН'Н, (відновлена форма)
і протонів від віднов-
Наступним етапом є перенесення електронів лених форм ФМН на убіхінони (коензим Q) (див. с 337).
На наступному етапі з ксензиму Q протони атомів водню переходять у навколишнє середовище, а електрони поступають на цитохромну систему. Цитохромна система складається з ряду оксидоредуктаз, не-білковою частиною яких є залізопорфірини, близькі за своєю будо'вою
336


2Н* h/)- 1
Отже, на завершальному етапі дихання здійснюються два процеси — приєднання до кисню електронів і перетворення його на негативно заряджений іон (іонізація), а потім приєднання до іонізованого кисню протонів з утворенням молекули води. Молекулярний кисень 02 приєднує до себе 4 електрони і 4 протони, а оскільки через систему цитохромів переноситься лише 2 електрони, використовується V2 02. Завершальний етап тканинного дихання можна зобразити такою схемою:
У
процесі перенесення
електронів через систему дихального
ланцюга проходить
поступове вивільнення акумульованої
в них енергії і до кисню
вони переносяться вже енергетично
бідними, тому утворення во-Ди
в організмі не супроводжується вибухом,
як у випадку утворення гримучого
газу.
перенесення
електронів через систему дихального
ланцюга проходить
поступове вивільнення акумульованої
в них енергії і до кисню
вони переносяться вже енергетично
бідними, тому утворення во-Ди
в організмі не супроводжується вибухом,
як у випадку утворення гримучого
газу.
357
З наведеної схеми видно, що процес перенесення електронів через систему цитохромів пов'язаний із зміною валентності атома заліза порфіринового ядра. В окислених цитохромах тривалентне залізо, приєднуючи електрони, перетворюється на двовалентне. З останнього цитохрому електрони переходять на цитохромоксидазу, яка далі окислюється безпосередньо киснем. У процесі клітинного дихання крім води утворюється CO* і виділяється енергія, яка акумулюється у вигляді АТФ/
Отже, в ланцюгу окислювально-відновних процесів створюється своєрідний електронний каскад. Послідовність розміщення основних компонентів дихального ланцюга визначається співвідношенням швидкості окислення і відновлення окремих компонентів системи, а також величиною редокс-потенціалів, що виникають між сусідніми компонентами. Перенесення електронів здійснюється завжди від меншого потенціалу до більшого. Для більшості органічних субстратів нормальні редокс-потенціали окислювально-відновних систем дорівнюють —j 0,6 В. Оскільки редокс-потенціал системи НАД -+■ НАД • Н + Н+ до-рівнюе — 0,32 В, електрони і протони від органічних субстратів переходять до нікотинамідних коферментів. Редокс-потеиціали системи ФАД-^ ФАД • Н, мають ще більшу величину (—0,06...—0,016 В), тому відбувається перенесення електронів від нікотинамідних дофла-віпових ферментів. Отже, редокс-потенціал показує напрям перенесення j електронів. Нижче наведено величини редокс-потенціалів основних] компонентів дихального ланцюга (табл. 18).
Існують також інші шляхи тканинного дихання — більш довгі і] більш короткі. Прикладом більш довгогр ланцюга тканинного дихання] може бути окислення а-кетокислот. При окислювальному декарбокси-люванні цих кислот два атоми водню передаються спочатку на ліпое-ву кислоту, а потім уже на никотинамідні коферменти. Більш короткими
Таблиця 18. Величини нормальних редокс-потенціалів основних компонентів окислювальнп-відновного ланцюга (при рН = 7 і Т = 38 СС)
Б іологічна
система
іологічна
система
Значення редокс-потеніПалу, В
Субстрати i=f 2H+ -f 2e
НАД • Н2 ±? НАД + 2Н+ + 2е
ФФ • 2Н, и ФФ -!- 2Н+ + 2е Цитох ром Ь ±s Цитох ром ft -f- e Цитох ром с ** Цитох ром с + є Цитохром а ±? Цитохром а + e ЦХО tf ЦХО + є H2Ot* 1/202 + 2Н+ + 2е
Від 0 до —0,62 —0,32 Від —0,06 до —4І,\
+0,04
+0,26
+0,29
+0,50
+0,815
33S
Примітку. Величина редокс-потенціалу виражена через є. р. в.
шляхом є окислення янтарної кислоти до фумарової. При цьому два атоми водню, минаючи нікотинамідні дегідрогенази, переносяться на флавопротеїди, які в цьому випадку виступають у ролі первинних дегідрогеназ (забезпечують безпосереднє окислення субстратів). З флавінових дегідрогеназ протони та електрони водню переходять на убіхінон. Протони водню з убіхінону переходять у розчин, а електрони через систему цитохромів переносяться до кінцевого акцептора — кисню. Більш коротший шлях окислення різних субстратів забезпечують ферменти оксидази, які у вигляді кофакторів містять ФМН і ФАД. За участю даних ферментів відбувається безпосереднє окислення субстратів шляхом перенесення атомів водню від субстратів, що окислюються, на молекулярний кисень:

Отже, флавопротеїди забезпечують відщеплення водню від субстрату та приєднання його до молекулярного кисню, минаючи систему цитохромів та цитохромоксидазу. Кінцевим продуктом окислення є не вода, а иероксид водню. Нині вивчено близько двадцяти оксидаз флавопротеї-нової природи, які у вигляді кофакторів містять ФМН і ФАД (ксанти-ноксидаза, глюкозооксидаза, оксалатексидаза, оксидази D-аміно-кислот тощо). Деякі оксидази у вигляді кофакторів містять мідьвмісні протеїни. Утворений пероксид водню розкладається ферментом ката-лазою на кисень і воду
У
балансі тканинного дихання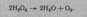 процеси,
що закінчуються утворенням пероксиду
водню, становлять лише 5—7
%.
процеси,
що закінчуються утворенням пероксиду
водню, становлять лише 5—7
%.
