
- •Раздел 1. Источники энергии при сварке
- •1.1. Физические основы и определение процесса сварки
- •1.2. Особенности формирования сварного соединения
- •1.3. Классификация процессов сварки
- •1.4. Требования к источникам энергии при сварке и оценка
- •1.5. Электрическая дуга как вид электрического разряда
- •1.6. Особенности электрической проводимости твердых тел,
- •1.7. Способы возбуждения сварочной дуги и ее зоны.
- •1.8. Общие законы образования заряженных частиц в газе
- •1.8.1. Ионизация газов
- •1.8.2. Фотоионизация
- •1.8.3. Ионизация соударением частиц
- •1.8.4. Термическая ионизация
- •1.8.5. Ионизация частиц в результате их ускорения
- •1.8.6. Эмиссионные процессы на поверхности твердых тел
- •1.8.7. Термоэлектронная эмиссия
- •1.8.8. Автоэлектронная эмиссия
- •1.8.9. Фотоэлектронная эмиссия
- •1.8.10. Вторичная эмиссия
- •1.9. Приэлектродные области дугового разряда
- •1.9.1. Катодная область
- •1.9.2. Анодная область
- •1.9.3. Столб дуги
- •1.10. Характеристика переноса электродного металла
- •1.10.1. Силы тяжести и поверхностного натяжения
- •1.10.2. Электродинамическая сила (пинч-эффект)
- •1.10.3. Реактивное давление, обусловленное интенсивным
- •1.10.4. Электростатические силы
- •1.10.5. Плазменные потоки
- •1.10.6. Влияние напряжения дуги на перенос металла
- •1.11. Устойчивость дугового разряда
- •1.12. Магнитная гидродинамика сварочной дуги
- •1.12.1. Собственное поле дуги и контура сварки
- •1.12.2. Внешнее магнитное поле и дуга
- •1.12.3. Практическое использование влияния на дугу поперечного магнитного поля
- •3. Вращающаяся (бегущая) дуга
- •1.13. Плазменнодуговые процессы
- •1.14. Лучевые источники энергии при сварке
- •1.14.1. Электроннолучевые источники
- •1.14.2. Фотоннолучевые источники
- •Раздел 2. Основы физической химии
- •2.2. Первое начало термодинамики и его следствия
- •2.3. Вычисление теплоемкостей веществ
- •2.4. Второе начало термодинамики
- •2.5. Понятие об изотермных потенциалах
- •2.6. Равновесие физико-химических систем
- •2.6.1. Закон действующих масс и константа равновесия
- •2.6.2. Закон действующих масс и константа равновесия
- •2.7. Максимальная работа реакции и ее связь
- •2.8. Влияние температуры и давления на
- •2.8.1. Влияние температуры на положение равновесия
- •2.8.2. Влияние давления на положение равновесия
- •2.8.3. Вычисление констант равновесия химических
- •2.9. Явления в жидких средах и на поверхностях
- •2.9.1. Закон распределения вещества в несмешивающихся
- •2.9.2. Практическая ценность закона распределения при изучении металлургических процессов
- •2.9.3. Поверхностная энергия
- •2.9.4. Адсорбция
- •2.9.5. Вязкость жидкости
- •2.9.6. Процессы испарения
- •2.10. Оценка химического сродства элементов к кислороду
- •2.10.1. Оценка степени сродства элементов к кислороду по изменению изобарно-изотермного потенциала образования окисла
- •2.10.2. Оценка степени химического сродства элементов к кислороду
- •2.10.3. Упругость диссоциации компонентов, находящихся в
- •Раздел III. Металлургические основы сварки плавлением
- •Радел IV. Основы тепловых процессов при сварке
- •Основные теплофизические единицы, понятия и определения
- •Дифференциальные уравнения теплопроводности
- •Стационарный процесс распространения теплоты
- •Теплоты при сварке
- •Мгновенный точечный источник теплоты в полубесконечном теле
- •Мгновенный линейный источник теплоты в пластине
- •Мгновенный плоский источник теплоты в стержне
- •Сварочные источники теплоты
- •Непрерывно действующие неподвижные источники теплоты
- •Непрерывно действующий неподвижный точечный источник теплоты на поверхности полубесконечного тела
- •Непрерывно действующий неподвижный линейный источник теплоты в пластине
- •Непрерывно действующий неподвижный плоский источник теплоты в стержне
- •Подвижные сосредоточенные источники теплоты
- •Подвижный точечный источник теплоты на поверхности полубесконечного тела
- •Мощные быстродвижущиеся источники теплоты
- •Расчеты термического цикла основного металла
- •Наплавка валика на массивное тело
- •Однопроходная сварка листов встык
- •Валиковая проба
- •Производительность дуговой сварки
- •Расплавление электрода
- •Проплавление основного металла
- •Определение времени пребывания металла сварочной ванны в расплавленном состоянии и длины сварочной ванны
- •2. Определение площади проплавления основного металла
- •3. Определение ширины зоны нагрева
- •Тепловая эффективность процесса сварки
- •Раздел V. Технологическая прочность сварных соединений Понятие технологической и эксплуатационной прочности
- •Трещины при сварке и их классификация
- •Горячие трещины при сварке
- •Методика оценки склонности металла сварного шва к образованию горячих трещин
- •Влияние различных факторов на вероятность образования горячих трещин
- •Холодные трещины при сварке
- •Методы определения стойкости металла околошовной зоны против образования холодных трещин
- •Методы определения стойкости против перехода в хрупкое состояние
- •Методы проверки эксплуатационных характеристик металла шва, околошовной зоны и сварного соединения
- •Пути повышения технологической прочности сварных соединений
- •Раздел VI. Свариваемость металлов Понятие свариваемости металлов. Факторы, определяющие свариваемость металлов
- •Влияние изменения химического состава на свариваемость
- •Ориентировочная оценка свариваемости стали по эквивалентному содержанию углерода
- •Характеристика свариваемости сталей
- •I. Свариваемость углеродистых конструкционных сталей
- •2. Свариваемость легированных сталей
- •2.1. Свариваемость низколегированных сталей
- •2.2. Свариваемость среднелегированных сталей
- •2.3. Свариваемость высоколегированных сталей
- •2.3.1. Свариваемость высоколегированной стали мартенситного класса
- •2.3.2. Свариваемость высоколегированной стали ферритного класса
- •2.3.3. Свариваемость высоколегированной стали аустенитного класса
- •2.3.4.Свариваемость высоколегированной стали карбидного класс
2.10.2. Оценка степени химического сродства элементов к кислороду
по упругости диссоциации окисла
При изучении закона действующих масс для гетерогенных систем было показано, что упругость диссоциации окисла совпадает с константой равно-весия, поэтому для определения упругости диссоциации окислов могут быть использованы термодинамические методы, применяемые для вычис-ления констант равновесия реакции.
Упругость
диссоциации окислов рассчитывают по
уравнению нор-мального химического
сродства (2.35). Поскольку для гетерогенной
системы константа равновесия
определяется парциальным давлением
газовой фа-зы, т. е.
![]() ,
можно записать
,
можно записать
![]() ,
,
тогда
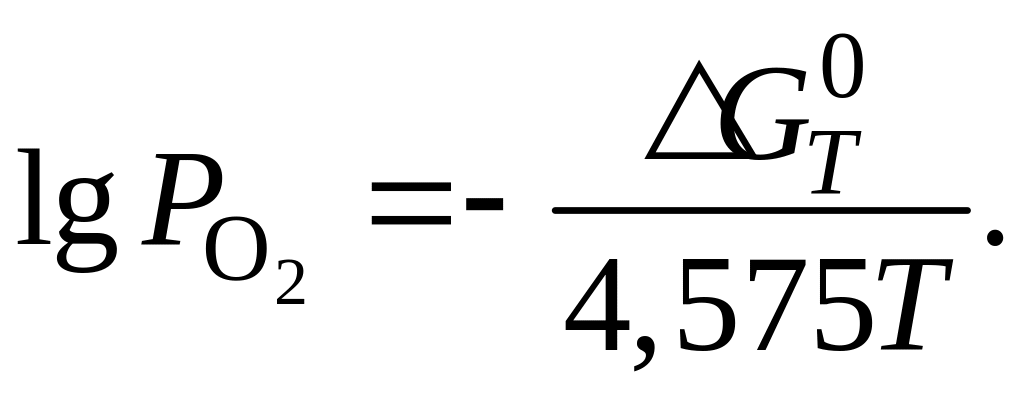 (2.36)
(2.36)
Из уравнения
(2.36) можно сделать вывод, что между
сродством к кис-лороду и упругостью
диссоциации окисла существует обратная
зави-си-мость, т. е. сродство к кислороду
тем больше, чем меньше упругость
диссоциации окисла. Поэтому для
определения направления химической
реакции достаточно сравнить упругость
диссоциации окисла
![]() с
дейст-вительным (фактическим) парциальным
давлением кислорода
с
дейст-вительным (фактическим) парциальным
давлением кислорода
![]() в усло-виях
диссоциации. При этом возможны три
случая:
в усло-виях
диссоциации. При этом возможны три
случая:
a)
![]() —
имеет место окисление элемента
кислородом, кото-рое протекает тем
энергичнее, чем больше разность
—
имеет место окисление элемента
кислородом, кото-рое протекает тем
энергичнее, чем больше разность
![]()
б)
![]() — имеет
место восстановление элемента из окисла,
которое протекает тем энергичнее, чем
больше разность
— имеет
место восстановление элемента из окисла,
которое протекает тем энергичнее, чем
больше разность
![]()
в)
![]() —
наступило
равновесие.
—
наступило
равновесие.
В обычных условиях (как и в условиях сварки) парциальное давление кислорода воздуха постоянно и равно 0,21 атм., что значительно упрощает сравнение упругости диссоциации окисла с парциальным давлением кис-лорода в условиях диссоциации.
Если упругость диссоциации окисла больше 0,21 атм., то металл на воздухе окисляться не будет (золото, серебро, платина). Однако для боль-шинства окислов упругость диссоциации в обычных условиях меньше 0,21 атм., поэтому на воздухе устойчивой формой будут окислы или руды.
Упругость диссоциации в сильной мере зависит от температуры. Для всех металлов с повышением температуры упругость диссоциации окисла повышается, а сродство элементов к кислороду уменьшается. Поэтому ино-гда металлы можно восстанавливать из окислов простым нагревом. На-пример, упругость диссоциации окисла ртути при температуре 20 °С со-ставляет 0,17 атм., а при температуре 440 °С — 0,28 атм. Вывод: чтобы восстановить ртуть из окисла надо его нагреть до температуры 440 °С.
Железо восстановить труднее, так как для закиси железа только при температуре 3000 °С упругость диссоциации становится равной 0,21 атм. Этот факт свидетельствует еще и о том, что пары железа в дуге окисляться не будут.
В практике анализа металлургических и сварочных процессов, когда приходится иметь дело с растворами (иногда очень сложными), расчеты упругости диссоциации окислов усложняются. Это связано с тем, что на порядок и скорость окисления элементов, находящихся в растворе, влияет не только температура процесса, но и концентрация этих элементов в раст-воре. Причем наличие нескольких элементов в растворе лишает их воз-можности свободно и независимо друг от друга реагировать с кислородом. В силу указанных обстоятельств возникает необходимость вычисления упругости диссоциации окислов компонентов, находящихся в растворе.
Недостаток метода оценки степени сродства элементов к кислороду по упругости диссоциации окисла заключается в том, что в ряде случаев по-лучаемые величины упругости настолько малы, что само понятие упруго-сти диссоциации как давления теряет физический смысл.
