- •1. Неметалічні елементи, розташування в періодичній системі, загальна характеристика
- •Для тих, хто вивчає хімію на академічному рівні
- •2. Прості речовини неметали. Явище алотропії.
- •Назви неметалічних елементів і неметалів за сучасною українською хімічною номенклатурою
- •Склад і властивості кисню й озону
- •Для тих, хто вивчає хімію на академічному рівні
- •3. Основні хімічні властивості та застосування неметалів.
- •1. Взаємодія неметалів з металами:
- •4. Застосування неметалів та поширення їх у природі
- •Запитання і завдання для самоконтролю знань
- •1. Колообіг Оксигену.
- •2. Колообіг Нітрогену.
- •3. Колообіг Карбону.
- •Запитання і завдання для самоконтролю знань
- •1. Загальна характеристика металічних елементів та утворених ними простих речовин
- •Приклади металів, назви яких не збігаються з назвами елементів за сучасною українською хімічною номенклатурою
- •2. Фізичні властивості та застосування металів
- •3. Загальні хімічні властивості металів, корозія металів
- •Запитання і завдання для самоконтролю знань
- •1. Метали і сплави в сучасній техніці. Застосування заліза, алюмінію та їх сплавів.
- •2. Поняття про металургію. Загальні способи добування металів.
- •Запитання і завдання для самоконтролю знань
- •Природні джерела вуглеводнів
- •Способи та основні продукти хімічної переробки кам'яного вугілля
- •Значення хімії як науки і її роль у вирішенні
- •Хімія 10-11 кл.: Органічна хімія [Підручник для 10-11 кл. Серед. Загальноосвіт. Шк. ] / Домбровський а.В., Лукашова с.М. – к.: Освіта, 2003.-192 с.
4. Застосування неметалів та поширення їх у природі
Поширення неметалів у природі. Неметали більш поширені в природі, аніж метали. До складу повітря входять: азот, кисень, інертні гази. Сірка утворює поклади самородної сірки. Родовища самородної сірки в Передкарпатті — одні з найбільших у світі. Існують родовища графіту, дуже рідко трапляються алмази. Промисловим родовищем графіту в Україні є Заваллівське родовище, сировину якого використовує Маріупольський графітовий комбінат. У декількох регіонах України виявлені поклади порід, які можуть містити алмази (зокрема, у Житомирській області, на Волині), проте промислові родовища поки що не відкриті. Значно більше атомів неметалічних елементів утворюють різноманітні складні речовини, серед яких домінують оксиди, солі.
Застосування неметалів. Застосування алотропних видозмін Оксигену й Карбону ми вже розглянули в попередньому параграфі. Інші неметали також мають різноманітне застосування. Ознайомитися з ним допоможе рисунок 9.
На рисунку 9 в описі застосування вуглецю подано новий для вас термін — адсорбція. Адсорбція — це здатність деяких речовин (адсорбентів), зокрема вуглецю, утримувати на своїй поверхні частинки газу або розчиненої речовини. При цьому адсорбент не змінюється, а лише утримує своєю пористою поверхнею газ чи рідину. Щоб повернути адсорбенту здатність до адсорбції та вилучити адсорбовану речовину, достатньо нагрівання.

На адсорбційній здатності вуглецю базується його використання в медицині з лікувальною метою — це пігулки або капсули активованого вугілля. Їх застосовують внутрішньо при отруєнні.
Українському вченому доктору хімічних наук, професору, члену кореспонденту НАН України Картелю Миколі Тимофійовичу належить створення адсорбентів медичного призначення, зокрема вуглецевих гемосорбентів, сумісних із кров’ю.
В адсорбційній здатності вугілля можна переконатися, провівши такий демонстраційний дослід (рис. 10). У циліндр, наповнений
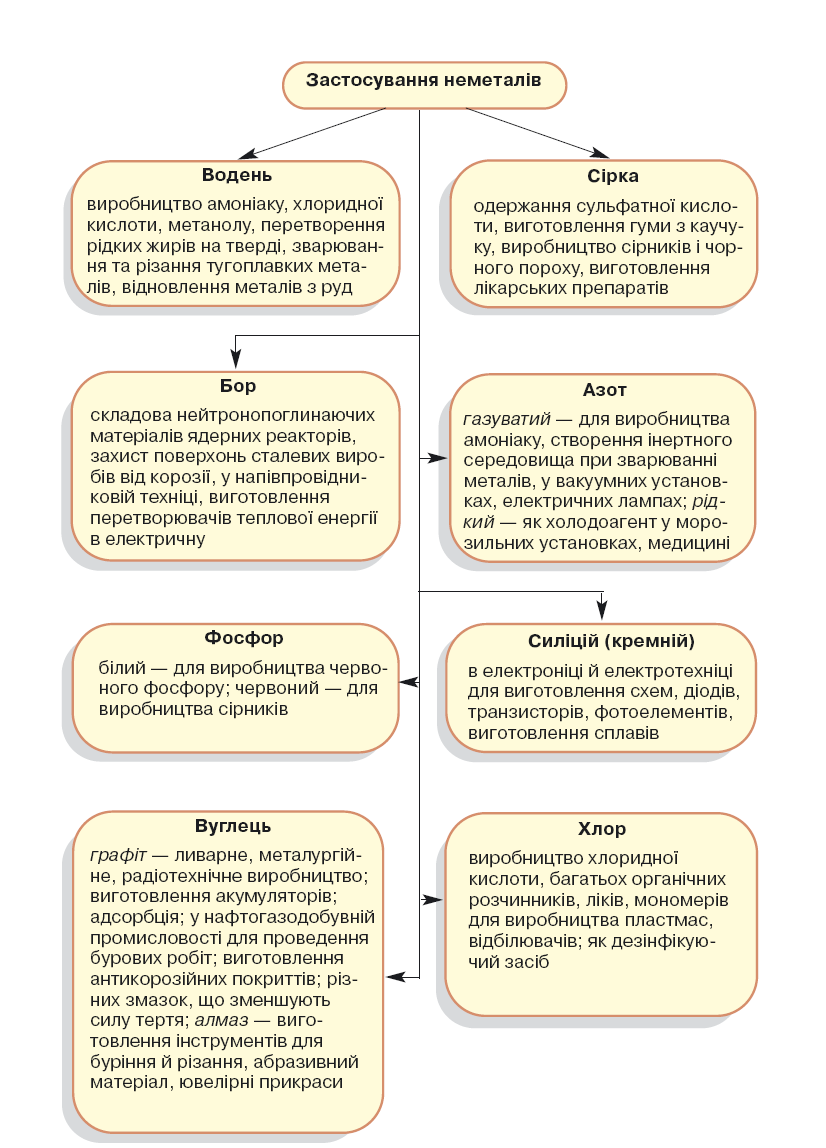 Рис.
9.
Застосування неметалів
Рис.
9.
Застосування неметалів

Рис. 10. Адсорбція Рис. 11. Протигаз:
нітроген(ІV) оксиду 1— коробка з адсорбентом;
вуглецем 2 — гумовий шолом
газуватим нітроген(ІV) оксидом і закритий пробкою (рис. 10а), помістити шматочки деревного вугілля або подрібнені пігулки активованого вугілля. Після кількаразового коливання циліндра буре забарвлення нітроген(ІV) оксиду зникає (рис. 10б). Якщо циліндр підігріти, воно знову з’являється. Подібний дослід можна провести з розчином чорнила.
Адсорбційну здатність вуглецю використав М. Д. Зелінський у винайденому ним у 1915 р. вугільному протигазі — засобі індиві дуального захисту органів дихання, обличчя й очей людини від дії шкідливих речовин, що знаходяться в атмосфері. У 1916 р. було налагоджено промисловий випуск винайденого вченим протигаза, це врятувало життя сотень тисяч солдатів під час Першої світової війни. Удосконалений протигаз застосовується й нині (рис. 11).
Особливості будови атомів неметалічних елементів, що зумовлюють хімічні властивості неметалів.
З вивченого в основній школі ви знаєте, що вища валентність атомів хімічних елементів дорівнює номеру групи, проте
існують винятки.
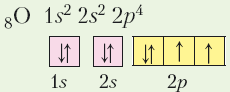
Зверніться до наведених графічних електронних формул неметалічних елементів, і ви побачите, що, крім Гідрогену, у всіх інших неметалічних елементів кількість неспарених електронів на зовнішньому енергетичному рівні менша за номер групи. Як відомо, валентність дорівнює кількості неспарених електронів. Тоді чому максимальна валентність і вищий ступінь окиснення атомів багатьох неметалічних елементів збігаються з номером групи? Причину цього з’ясуємо на прикладі Оксигену й Сульфуру — неметалічних елементів VІ групи головної підгрупи періодичної системи хімічних елементів.
Обидва елементи на зовнішньому енергетичному рівні мають по 6 електронів:
![]()
І все ж Оксиген не буває шестивалентним, тоді як у Сульфуру існують сполуки з валентністю 6 і вищим ступенем окиснення +6. Чим це пояснити? Звернемося до графічних електронних формул атомів цих елементів:
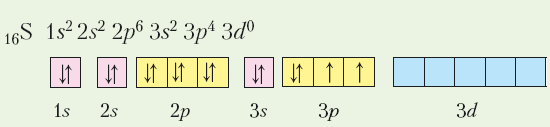
Виходячи з графічних електронних формул атомів Оксигену й Сульфуру, робимо висновок, що в Оксигену відсутні вільні енергетичні комірки й атом не може перейти в збуджений стан та мати більше двох неспарених (валентних) електронів, тоді як для Сульфуру це реально, тому що наявність вільних комірок на d підрівні третього енергетичного рівня надає можливість спареним електронам стати неспареними:
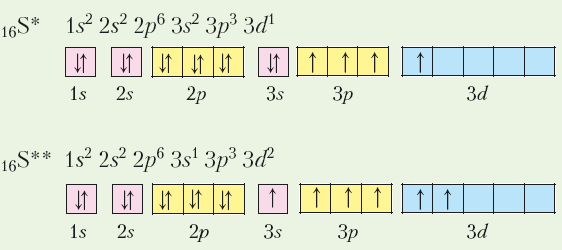
У такий спосіб атом Сульфуру розширює свої валентні можливості.
Особливості будови атомів неметалічних елементів, що зумовлюють утворення хімічних зв’язків, і хімічні властивості неметалів як простих речовин дають змогу зробити такі висновки:
• усі валентні електрони в атомах неметалічних елементів розташовані на зовнішньому енергетичному рівні, який містить половину, а то й більше половини електронів, аніж завершений енергетичний рівень (електроннийшар);
• атоми неметалічних елементів можуть переходити в збуджений стан, якщо мають на зовнішньому енергетичному рівні вільні енергетичні комірки, збільшуючи цим самим кількість неспарених електронів. Тоді вища валентність і максимальний ступінь окиснення атома неметалічного елемента збігається з номером групи;
• у хімічних реакціях атоми неметалічних елементів досягають завершеності зовнішнього енергетичного рівня приєднанням електронів або утворенням спільних електронних пар. Яким саме способом це відбувається, залежить від будови електронних оболонок атомів реагентів.