
- •1. Неметалічні елементи, розташування в періодичній системі, загальна характеристика
- •Для тих, хто вивчає хімію на академічному рівні
- •2. Прості речовини неметали. Явище алотропії.
- •Назви неметалічних елементів і неметалів за сучасною українською хімічною номенклатурою
- •Склад і властивості кисню й озону
- •Для тих, хто вивчає хімію на академічному рівні
- •3. Основні хімічні властивості та застосування неметалів.
- •1. Взаємодія неметалів з металами:
- •4. Застосування неметалів та поширення їх у природі
- •Запитання і завдання для самоконтролю знань
- •1. Колообіг Оксигену.
- •2. Колообіг Нітрогену.
- •3. Колообіг Карбону.
- •Запитання і завдання для самоконтролю знань
- •1. Загальна характеристика металічних елементів та утворених ними простих речовин
- •Приклади металів, назви яких не збігаються з назвами елементів за сучасною українською хімічною номенклатурою
- •2. Фізичні властивості та застосування металів
- •3. Загальні хімічні властивості металів, корозія металів
- •Запитання і завдання для самоконтролю знань
- •1. Метали і сплави в сучасній техніці. Застосування заліза, алюмінію та їх сплавів.
- •2. Поняття про металургію. Загальні способи добування металів.
- •Запитання і завдання для самоконтролю знань
- •Природні джерела вуглеводнів
- •Способи та основні продукти хімічної переробки кам'яного вугілля
- •Значення хімії як науки і її роль у вирішенні
- •Хімія 10-11 кл.: Органічна хімія [Підручник для 10-11 кл. Серед. Загальноосвіт. Шк. ] / Домбровський а.В., Лукашова с.М. – к.: Освіта, 2003.-192 с.
1. Взаємодія неметалів з металами:



З’ясуємо, чи належить рівняння реакції магнію з киснем до окисновідновних:
![]()
Відбулася зміна ступенів окиснення Магнію та Оксигену. Отже, це окисновідновна реакція. Напишемо її електронний баланс, визначимо окисник і відновник:

А як змінилася будова електронних оболонок атомів Магнію та Оксигену в утвореній сполуці?
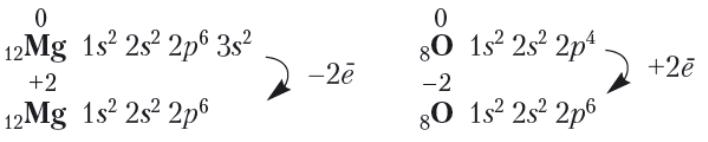
Як бачимо, в обох випадках зовнішні енергетичні рівні набули завершеної конфігурації: Магнію — за рахунок віддавання 2 електронів, в Оксигену — за рахунок приєднання 2 електронів.
2. Взаємодія неметалів із неметалами. За певних умов неметали взаємодіють між собою, утворюючи сполуки з ковалентним хімічним зв’язком, які називають за зазначеними вище правилами номенклатури.
Взаємодія неметалів з киснем: (2.1)

До реакції атоми Карбону й Оксигену входять до складу простих речовин зі ступенями окиснення 0. В утвореному оксиді менш електронегативний Карбон має ступінь окиснення +4, тоді як у більш енергонегативного Оксигену він дорівнює –2.
СО2 — сполука двох неметалічних елементів. Їм властива загальна тенденція атомів неметалічних елементів утримувати власні електрони та зміщувати до себе електрони менш електронегативних елементів. Тому жоден з атомів не віддає електрони, натомість утворюються спільні електронні пари, зміщені до атомів більш електронегативного елемента Оксигену:
![]()
Ц е
можна передати структурною формулою
О=С=О.
е
можна передати структурною формулою
О=С=О.
Окрім оксидів, найактивніші метали, а також Гідроген утворюють пероксиди (наприклад, Na2O2, K2O2, BaO2, Н2O2).
Кислотний характер солетвірних оксидів неметалічних елементів. Усі солетвірні оксиди неметалічних елементів — кислотні. На підтвердження цього виконаємо демонстраційний дослід зі спалюванням сірки й доведемо кислотний характер утвореного оксиду. (Увага! Дослід виконується у витяжній шафі). Наповнимо металеву ложечку для спалювання речовин на 1/3 сіркою і нагріємо її в полум’ї нагрівального приладу. Спочатку сірка плавиться, а згодом починає горіти синюватим полум’ям (рис. 8а). Після цього внесемо ложечку в колбу з киснем і щільно закриємо пробкою. У кисні горіння стає набагато яскравішим (рис. 8б).

Рис. 8. Горіння сірки на повітрі (а) і в кисні (б)
Після повного припинення горіння виймемо ложечку для спалювання з колби, а стінки колби ополоснемо 3–4 мл дистильованої води. Одержаний безбарвний прозорий розчин віділлємо в пробірку й випробуємо індикатором, наприклад метиловим оранжевим. Розчин набуває властивого кислому середовищу рожевого забарвлення. Повторимо дослід, але вже з фенолфталеїном. Після додавання до розчину кількох крапель цього чутливого на лужне середовище індикатора поява малинового забарвлення не спостерігається. Отже, продуктом взаємодії води з утвореною внаслідок спалювання сірки речовиною є кислота. Запишемо рівняння здійснених реакцій:
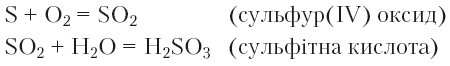
З наведених рівнянь бачимо, що продуктом горіння сірки є кислотний оксид SO2, який з водою утворює сульфітну кислоту H2SO3.
Взаємодія неметалів із воднем: (2.2)
Н2 + Сl2 = 2НСl (гідроген хлорид, або хлороводень)
Н2 + S = Н2S (гідроген сульфід, або сірководень)
При взаємодії більшості неметалів із воднем утворюються бінарні сполуки з ковалентним полярним хімічним зв’язком. Підтвердимо це на прикладі сірководню. В атома Сульфуру до завершення зовнішнього енергетичного рівня не вистачає двох електронів, а в атома Гідрогену — одного. За рахунок утворення Сульфуром двох спільних електронних пар із двома атомами Гідрогену зовнішній енергетичний рівень електронної оболонки атома Сульфуру стає завершеним. Оскільки Сульфур більш електронегативний, то спільні електронні пари зміщуються в бік його атома і зв’язок, що утворився, є ковалентним полярним:
![]()
Унаслідок реакції ступені окиснення атомів зазнали змін:
![]()
Гідроген і Сульфур не належать ні до одного періоду, ні до однієї підгрупи. Тому, щоб з’ясувати, який із неметалів окисник, а який відновник, скористаємося рядом електронегативності. З нього дізнаємося, що Гідроген менш електронегативний, аніж Сульфур, і в електронному балансі потрібно показати віддавання електронів Гідрогеном, а приєднання Сульфуром:


Взаємодія неметалів з іншими неметалами. (2.3)
Окрім взаємодії з киснем і воднем, неметали взаємодіють також з іншими неметалами, наприклад:
С + 2S = CS2 (карбон(IV) сульфід)
S i
+ 2Cl2
= SiCl4
(силіцій(IV) хлорид)
i
+ 2Cl2
= SiCl4
(силіцій(IV) хлорид)
