
- •1. Неметалічні елементи, розташування в періодичній системі, загальна характеристика
- •Для тих, хто вивчає хімію на академічному рівні
- •2. Прості речовини неметали. Явище алотропії.
- •Назви неметалічних елементів і неметалів за сучасною українською хімічною номенклатурою
- •Склад і властивості кисню й озону
- •Для тих, хто вивчає хімію на академічному рівні
- •3. Основні хімічні властивості та застосування неметалів.
- •1. Взаємодія неметалів з металами:
- •4. Застосування неметалів та поширення їх у природі
- •Запитання і завдання для самоконтролю знань
- •1. Колообіг Оксигену.
- •2. Колообіг Нітрогену.
- •3. Колообіг Карбону.
- •Запитання і завдання для самоконтролю знань
- •1. Загальна характеристика металічних елементів та утворених ними простих речовин
- •Приклади металів, назви яких не збігаються з назвами елементів за сучасною українською хімічною номенклатурою
- •2. Фізичні властивості та застосування металів
- •3. Загальні хімічні властивості металів, корозія металів
- •Запитання і завдання для самоконтролю знань
- •1. Метали і сплави в сучасній техніці. Застосування заліза, алюмінію та їх сплавів.
- •2. Поняття про металургію. Загальні способи добування металів.
- •Запитання і завдання для самоконтролю знань
- •Природні джерела вуглеводнів
- •Способи та основні продукти хімічної переробки кам'яного вугілля
- •Значення хімії як науки і її роль у вирішенні
- •Хімія 10-11 кл.: Органічна хімія [Підручник для 10-11 кл. Серед. Загальноосвіт. Шк. ] / Домбровський а.В., Лукашова с.М. – к.: Освіта, 2003.-192 с.
Для тих, хто вивчає хімію на академічному рівні
Окрім Оксигену й Карбону, алотропні видозміни мають й інші неметалічні хімічні елементи, зокрема Фосфор і Сульфур.
Алотропні видозміни Фосфору. Серед алотропних видозмін Фосфору найбільш поширені: білий фосфор (молекулярна будова кристалічної ґратки), червоний і чорний фосфор (атомна будова кристалічної ґратки). Усі вони — тверді речовини з кольором, зазначеним у назві. Змінюючи температуру, одну алотропну видозміну Фосфору можна за кілька годин перетворити на іншу.
Білий фосфор — безбарвна, з часниковим запахом, воскоподібна речовина, що світиться в темряві, дуже отруйна, самозаймається на повітрі при температурі
+50 °С. Унаслідок високої хімічної активності його зберігають під водою і по можливості в темряві.
Червоний фосфор (рис. 5б) порівняно з білим стійкіший до нагрівання, без запаху, менш реакційно здатний і неотруйний. Його використовують у виробництві сірників (входить до складу намазки сірникової коробки). При швидкому проведенні головкою сірника по намазці фосфор окиснюється наявною в головці речовиною калій хлоратом KClO3. Від цього інша речовина головки — сірка — загорається й підпалює дерев’яну частину сірника.
Ч орний
фосфор
має подібну
з графітом будову і проводить електричний
струм.
орний
фосфор
має подібну
з графітом будову і проводить електричний
струм.
Алотропні видозміни Сульфуру. Природною алотропною видозміною Сульфуру є ромбічна сірка.Це лимонножовта,крихка, кристалічна речовина без запаху, нерозчинна у воді. Назва пов’язана з тим, що її кристали мають форму октаедра зі зрізаними кутами (рис. 6а).
Рис. 6. Алотропні видозміни Сульфуру:
ромбічна (а), моноклінна (б) і
пластична (в) сірка
Молекула такої сірки складається з 8 атомів Сульфуру (у рівняннях реакцій послуговуються записом одного атома S).
При температурі +119,5 °С ромбічна сірка плавиться й перетворюється на моноклінну сірку — майже білі кристалічні пластинки (рис. 6б). Ця алотропна видозміна Сульфуру нестійка і вже при температурі +95,6 °С знову перетворюється на ромбічну сірку.
Якщо доведену до кипіння сірку (температура кипіння +444,6 °С) вилити в холодну воду, то під впливом різкого перепаду температур вона перетвориться на
пластичну сірку (рис. 6в). Пластична сірка має жовтокоричневий колір, ріжеться ножем, гумоподібна й еластична (витягується в нитки). На повітрі вона за кілька днів знову стає ромбічною сіркою.
До досягнень сучасної хімії належить створення кластерних частинок. Кластер у хімії — це складне об’єднання атомів чи молекул, яке є самостійною частинкою й наділене певними властивостями. Кластерні частинки з 60–70 атомів Карбону дістали назву фулерени і вуглецеві нанотрубки (рис. 7). З їх відкриттям набули стрімкого розвитку нанотехнології.
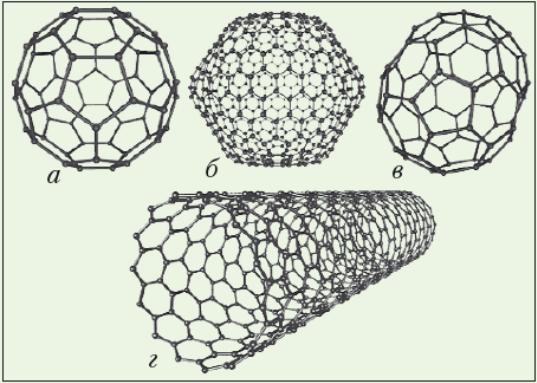
Рис. 7. Моделі фулеренів (а, б, в) і вуглецеві нанотрубки (г)
3. Основні хімічні властивості та застосування неметалів.
Основні хімічні властивості неметалів.
Неметали, за винятком інертних (благородних) газів, є досить хімічно активними простими речовинами, що взаємодіють із металами, іншими неметалами, а деякі також зі складними речовинами (наприклад, горіння та хлорування метану СН4, горіння етанолу С2Н5ОН).
Маючи на зовнішньому енергетичному рівні половину й більше половини електронів, аніж їх міститься на завершеному зовнішньому енергетичному рівні, атомам неметалічних елементів енергетично вигідніше приєднувати, а не віддавати електрони. Тому в реакціях із металами атоми неметалічних елементів приєднуютьелектрони, а в реакціях з неметалами утворюють спільні електронні пари. Дізнатися, до атома якого з двох неметалічних елементів зміщуються спільні електронні пари в молекулі, допомагає ряд електронегативності:
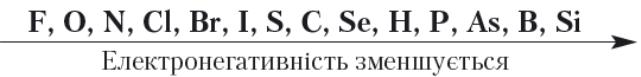
Варто також
пригадати, як змінюються неметалічні
властивості елементів, розташованих в
одному періоді й одній підгрупі.

Розглянемо конкретні приклади хімічних властивостей неметалів.
