
- •Тема 1: определение энтальпии нейтрализации
- •Тема 2: химическая кинетика и химическая равновесие
- •Лабораторная работа №2
- •Лабораторная работа №3
- •Ход работы
- •Лабораторная работа № 4
- •Экспериментальная часть Опыт № 1. Определение жесткости воды.
- •Опыт № 3. Определение щелочности воды.
- •Опыт №4.Определение концентрации кислорода, растворенного в воде
- •Проведение анализа
- •Опыт №5 «Определение солености воды»
- •Биогенные элементы
СНУЯЭиП
ЛАБОРАТОРНЫЙ ЖУРНАЛ
ПО ХИМИИ
Студента класса
---------------------------------
Севастополь 2013
Лабораторное занятие № 1
ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
Тема 1: определение энтальпии нейтрализации
Цель работы: экспериментальное определение энтальпии нейтрализации и определение зависимости ΔНнейт. от силы кислоты и основания
Ход работы:
Взять по 100 мл раствора основания и кислоты и определить их температуру(t1)
Через воронку влить раствор кислоты и основания в калориметр и перемешать.
Отметить самую высокую температуру (t2) в калориметре.
О
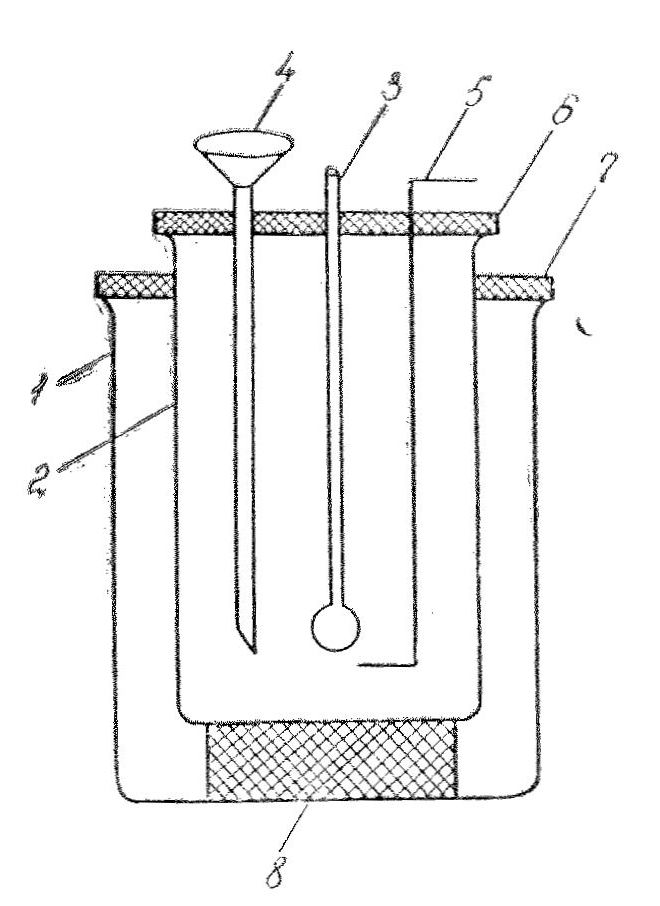 бработать
результаты эксперимента:
бработать
результаты эксперимента:
t1=
t2=
mр-ра= масса раствора;
mст = масса калориметрического стакана;
Ср-ра = 4,18 Дж/г∙град теплоёмкость раствора;
Сст = 0,753 Дж/г∙град теплоёмкость стекла
1)Расчёт теплоёмкости системы: ΣС = С1∙ m1 + С2∙ m2 ; Дж/град
2)Расчёт количества выделевшегося тепла: ΔНx = (t2 – t1) ΣС; кДж
3)Расчёт
энтальпии нейтрализации: ΔНнейт.=
 ;
кДж/Мэq
;
кДж/Мэq
Уравнения реакций:
NaOH + 1/2H2SO4=1/2Na2SO4 + H2O(nc), ΔН1=
NaOH + CH3COOН = CH3COONa + H2O, ΔН2=
NH4OH + 1/2H2SO4 = 1/2 (NH4 )2SO4 + H2O, ΔН3=
NH4OH + CH3COOH = CH3COONH4 + H2O, ΔН4=
Вывод:
Тема 2: химическая кинетика и химическая равновесие
Цель работы: экспериментально определить зависимость скорости реакции от концентрации, температуры, площади поверхности твёрдого реагента, катализатора; влияние температуры на смещение химического равновесия.
Экспериментальная часть:
Опыт №1. Влияние концентрации реагентов на скорость реакции.
Методика проведения эксперимента:
в 1-й цилиндр налить 30мл KIO3
во 2-й цилиндр налить 20 мл KIO3 и 10 мл H2O
в 3-й цилиндр налить 10 мл KIO3 и 10 мл H2O
в 3 цилиндра налить 30 мл «рабочего» раствора (Na2SO4 + H2SO4 +крахмал)
слить по очереди попарно KIO3 и «рабочий» раствор, каждый раз определяя время
с момента сливания до появления синего окрашивания в каждом цилиндре.
Уравнение реакции: 2 KIO3 + 5Na2SO3 + H2SO4 = K2SO4 + 5Na 2SO4+ I2↓ + H2O
Результаты эксперимента:
Концентрация С KNO3
|
10
|
20 |
30 |
Время τ (сек) |
|
|
|
Относительная Скорость υ=1/ τ |
|
|
|
 υ=1/ τ
υ=1/ τВывод:
10 20 30 C

Опыт№2. Влияние температуры на скорость реакции.
Методика проведения эксперимента:
в две пробирки налить 1мл H2SO4 и 1мл Na2S2O3 , слить растворы и засечь время до появления мути при комнатной температуре.
Подобное провести при температуре на 100 выше, для этого в стакан налить тёплой воды и опустить туда пробирки с реагентами. Температуру воды в стакане измерить термометром.
Слить содержимое пробирок с реагентами подобно (1) при температуре на 200 выше комнатной.
Вычислить относительную скорость реакции и построить график зависимости скорости реакции от концентрации.
Вычислить, во сколько раз скорость второй реакции выше первой, третей выше второй. Полученные реакции занести в таблицу.
Уравнение реакции: Na2S2O3 + H2SO4 = NaHSO4 + SO2↑ + S↓ + H2O
Результаты эксперимента:
|
Температура 0С |
Время появления мути, τ, сек |
Относительная скорость реакции υ=1/ τ |
Во сколько раз изменилась скорость |
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
υ=1/
τ 
 t0,C
t0,C
Вывод:
Опыт№3. Влияния катализатора на скорость реакции.
Методика проведения эксперимента:
в две пробирки положить по грануле Zn
прилить по 5мл раствора H2SO4 и 5 капель раствора KMnO4
в одну из пробирок добавить 5 капли катализатора KNO3. Пробирки встряхнуть и посмотреть скорость изменение окраски растворов.
У равнение
реакции:
5 Zn + 8 H2SO4
+ 2 KMnO4
KNO3
5 Zn SO4
+ 2MnSO4
+ K2SO4
+8 H2O
равнение
реакции:
5 Zn + 8 H2SO4
+ 2 KMnO4
KNO3
5 Zn SO4
+ 2MnSO4
+ K2SO4
+8 H2O
Наблюдения:
Вывод:
Опыт№4. Влияние площади поверхности реагентов на скорость реакции.
Методика проведения эксперимента:
в
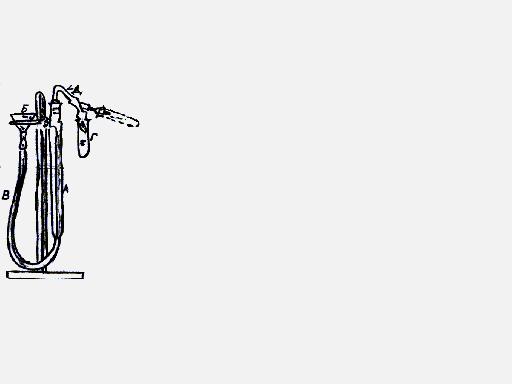 пробирку кусочками мрамора налить
раствор HCl (⅓ пробирки) и быстро
присоединить к установке, включить
секундомер и определить время за которое
вытиснится из бюретки 10 мл H2O.
пробирку кусочками мрамора налить
раствор HCl (⅓ пробирки) и быстро
присоединить к установке, включить
секундомер и определить время за которое
вытиснится из бюретки 10 мл H2O.Тоже проделать с порошком мрамора, но весу, разному кусочкам мрамора.
Уравнение реакции: 2 HCl + CaCO3 = H2O + CO2↑ + CaCO3
υ=1/ τ
|
Время τ,сек |
υ=1/ τ |
Мрамор кусочками (S1) |
|
|
Мрамор порошком (S2) |
|
|


Вывод: S1 S2 S
Опыт№5. Влияние температуры на смещение равновесия.
Методика проведения эксперимента:
в пробирку налить 5мл раствора CH3COOH и добавить 2 капли фенолфталеина
налить в стакан горячей воды и поместить в него пробирку с приготовленной смесью веществ и наблюдать изменение окраски раствора в пробирке.
Наблюдения:
Уравнение реакции: ΔН
;CH3COONa + H2O
 NaOH + CH3COOH;
ΔН
NaOH + CH3COOH;
ΔН
Вывод:
