
- •Раздел 1. Понятие о биотехнологии
- •Раздел 2. Биологические объекты в биотехнологии
- •Микробная, растительная и животная клетка – основной объект биотехнологии
- •Прокариотическая клетка
- •Тема 2.2. Вирусы, бактерии, грибы, растения, животные как объекты биотехнологии
- •Тема 2.3. Рост и культивирование микроорганизмов (из Микробиологии под ред. А.А. Воробьева)
- •2.3.1. Влияние условий среды на рост микроорганизмов
- •2.3.1. Основные факторы среды, определяющие рост и биосинтетическую активность продуцентов
- •2.3.2. Методы культивирования микроорганизмов
- •Основные биополимеры клеток
- •Раздел 4. Инженерная энзимология
- •Ферментативный катализ и основы кинетики ферментативных реакций
- •Носители для иммобилизации ферментов
- •Раздел 5. Инженерные основы биотехнологии
- •Тема 5.1. Понятие о биотехнологическом процессе и биотехнологической стадии
- •Классификация биотехнологических продуктов
- •Тема 5.2. Биотехнологическое производство
- •Тема 5.3. Производство витаминов
- •Тема 5.4. Использование биотехнологии в энергетике
- •Подготовка Компримирование Биогаз
- •Биологическая очистка стоков
- •Раздел 6. Генетическая инженерия Федеральный закон о государственном регулировании в области генно-инженерной деятельности
- •0 Внесении изменений и дополнений в федеральный закон «о государственном регулировании в области генно-инженерной деятельности»
- •12 Июля 2000 г. № 96-фз
- •Федеральный закон "о временном запрете на клонирование человека"
- •Принят Государственной Думой 19 апреля 2002 года
- •Тема 6.1. Понятие генетической инженерии
- •Тема 6.2. Использование генноинженерных методов в медицине
- •2.1. Методы генетической трансформации растений
- •0 Внесении изменений и дополнений в федеральный закон
- •12 Июля 2000 г. № 96-фз
- •Федеральный закон "о временном запрете на клонирование человека"
2.3.1. Основные факторы среды, определяющие рост и биосинтетическую активность продуцентов
Для нормальной жизнедеятельности микроорганизмов питательная среда должна быть стерильной, содержать водный раствор или суспензию усвояемых форм углерода, азота, фосфора, и других необходимых макро- и микроэлементов и иметь оптимальные значения температуры, рН, окислительно-восстановительного потенциала, осмотического давления и т. д. (табл.5). Отрицательные факторы задерживают рост и образование целевого продукта, и даже вызывают отмирание части клеток.
Как правило, микроэлементы поступают в среду с водой, но при необходимости (при недостатке их в воде) они могут быть добавлены в нее.
Некоторым микроорганизмам необходимо наличие в составе питательной среды так называемых дополнительных факторов роста, главным образом витаминов. В качестве факторов роста применяют автолизаты и гидролизаты дрожжей и других микроорганизмов, кукурузный экстракт, отвары растительных отходов и т. д.
Состав питательной среды для каждого продуцента устанавливается экспериментально.
Таблица 5
Основные факторы среды, определяющие рост и биосинтетическую активность продуцентов
Фактор
|
Роль при культивировании |
Методы управления
|
Состав и концентрация пита тельных веществ |
Обеспечивают метаболизм
|
Составление оптимальной композиции; подпитка во время ферментации непрерывность процесса; многостадийность с учетом потребностей продуцента по фазам развития и др. |
Концентрация продукта и ингибиторов
|
Замедляет биохимические реакции |
Осаждение продукта по мере накопления; ферментация с диализом; ферментация под разрежением с испарением летучего продукта и др. |
рН
|
Оптимизирует скорости биохимических реакций (пределы от 3,5 до 9,0) |
Регулирование путем добавления кислоты или щелочи |
Температура |
Оптимизирует скорость биохимических реакций (обычно равна 20-70° С) |
Охлаждение или подогрев культуральной жидкости при помощи теплообменников или температуры подаваемых в биореактор субстратов |
Осмотичес-кое давление или активность воды
|
Определяет границы жизни (составляет 0,6 - 0,998)
|
Составление сред с оптимальной концентрацией питательных веществ или влажностью твердой среды; поддержание на постоянном уровне во время ферментации путем разбавления водой или добавления отдельных компонентов |
Содержание растворенного кислорода
|
Для аэробов обеспечивает аэробный метаболизм; является акцептором Н+; ингибирует развитие микробов |
Для аэробных процессов регулируют интенсивностью аэрации или добавлением к газовой смеси кислорода; при атмосферном давлении и 20* С в литре среды растворяется 0,28 мМ 02. Анаэробные процессы реализуют в бескислородной среде, что достигается продуванием N2 и СО2 или добавками восстановителей (цистеина, аскорбиновой кислоты и др.) |
Содержание диоксида углерода
|
Источник углерода для автотрофов, гетеротрофы некоторые нуждаются, а некоторые замедляют метаболизм в присутствии СО2
|
Продувание в фотосинтезирующих процессах ферментации газовой средой, обогащенной СО2, выделению СО2 из жидкой фазы способствует перемешивание
|
Перемешивание среды
|
Равномерное распределение питательных веществ и биомассы по всему пространству среды
|
Организуют макро- и микроперемешивание в биореакторах при помощи механических мешалок, барбо-тажных, циркуляционных и других систем. Аэрация способствует перемешиванию, а пенообразование -флотации продуцента; флокуляция способствует осаждению биомассы |
Вязкость среды
|
Определяет диффузию питательных веществ и перемешивание клеток продуцента
|
Регулирование компонентами питания, характером и концентрацией биомассы, а также наличием некоторых полимерных экстрацеллюлярных продуктов. Вязкость влияет на перемешивание и аэрацию, для чего требуются специальные технические средства |
По оптимальным для роста температурам микроорганизмы условно делят на психрофилы (1), мезофилы (2) и термофилы (3) (рис. 7).
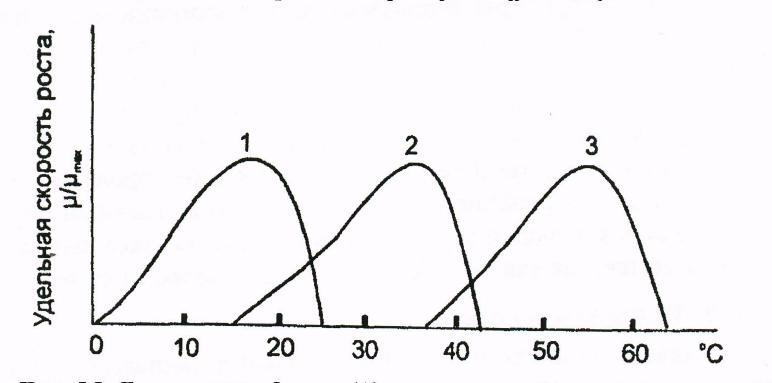
Рис. 7. Влияние температуры на удельную скорость роста микроорганизмов
В промышленности главным образом применяют мезофилы, имеющие оптимальную температуру около 30° С. В последнее время повышенный интерес вызывают термофилы, которые менее чувствительны к контаминации и обладают более высокими кинетическими характеристиками. Кроме того, термофилы продуцируют термостабильные вещества, главным образом, ферменты.
Существенное влияние на рост культуры и образование продукта оказывает кислотно-щелочная реакция среды. Наиболее часто промышленные микроорганизмы культивируют при рН 4-8. Некоторые дрожжи и плесневые грибы хорошо растут в кислой среде при рН 3-4, и это свойство можно использовать для борьбы с бактериальной инфекцией.
Среды для культивирования микроорганизмов
Основные термины. Выращивание микроорганизмов на питательных средах называют культивированием, а развивающиеся в результате микроорганизмы – культурой. При развитии в жидкой среде культуры образуют суспензии, осадок или пленку, при развитии в плотной среде – колонии. Культура может быть чистой, т.е. содержит потомство клетки только одного вида, и накопительной, т.е. состоять преимущественно из клеток одного вида микроорганизмов.
Внесение клеток микроорганизмов или какого-либо исследуемого материала (образца почвы, пробы воды) в стерильную питательную среду для получения чистой или накопительной культур называют посевом. Перенесение уже выращенных клеток из одной среды в другую (стерильную) называют пересевом.
Бактерии выращивают на естественных и искусственных питательных средах. Естественные среды (молоко, сусло-агар, сиропы и др.) имеют несбалансированное соотношение компонентов, их состав полностью не изучен. Искусственные питательные среды включают вещества в строго определенных соотношениях с учетом потребностей данного вида в питательных веществах, ростовых добавках, солях и т.п.
Среды различаются в зависимости от консистенции, состава и назначения: по консистенции — плотные, полужидкие и жидкие; по составу — простые, сложные органические и синтетические (искусственные); по назначению — специальные, элективные и дифференциально-диагностические.
В качестве жидких сред используют мясо - пептонный бульон (МПБ), обезжиренное молоко, пивное сусло, дрожжевые среды, бобовый отвар.
Пептон - первый продукт гидролиза белка с высокой молекулярной массой.
Плотные питательные среды используют для учета количества бактерий, выделения чистой культуры и других целей. Такие среды готовят из жидких, добавляя гелеобразные вещества: 1,5…2,5% агар-агара или 10...15% желатина. При приготовлении полужидких сред вносят 0,1...0,2 % агар-агара. Так получают мясо - пептонный агар, мясо - пептонный желатин, картофельный агар, сусло-агар.
Эти простые питательные среды применяют для выращивания многих бактерий.
Агар-агар - это растительный полисахарид, получаемый из некоторых морских водорослей.
Желатин - кислый азотсодержащий продукт, добываемый при выварке костей и хрящей.
ПРАКТИКУМ ПО МИКРОБИОЛОГИИ ( Е.З. Теппер, В.К. Шильникова, Г.И. Переверзева)
Мясо-пептонный бульон (МПБ). Для приготовления мясо-пеп-тонных сред используют мясной бульон, который получают так: 500 г мелко изрубленного свежего мяса без костей, жира и сухожилий заливают в эмалированной кастрюле 1 л водопроводной воды, нагретой до 50 °С, и оставляют настаиваться 12 ч при комнатной температуре или 1 ч при 50...55 °С. Мясо отжимают, экстракт процеживают через марлю со слоем ваты, кипятят 30 мин для свертывания коллоидных белков и фильтруют дважды (первый раз через марлю с ватой, второй - через бумажный фильтр). Фильтрат доливают водой до 1 л, разливают в колбы, закрывают ватными пробками и стерилизуют при 120 °С 20 мин (пробки колб закрывают сверху колпачками из бумаги). Ватные пробки должны
V/
О
Мясной бульон может быть использован в любое время для приготовления соответствующих сред. Если их готовят сразу после получения бульона, то предварительная стерилизация излишня.
Нередко в лабораторных условиях мясной настой кипятят вместе с мясом, а затем мясо отжимают. Бульон также получается хорошего качества. Если желательно иметь мясной бульон особо высокой питательности, во время настаивания мяса с водой добавляют немного пепсина, а готовый бульон подкисляют соляной кислотой. Пепсин дополнительно гидролизует белковые соединения мяса, и количество усвояемых бактериями питательных веществ возрастает. Мясо можно заменить мясным экстрактом из расчета 5 г на 1 л среды.
Для приготовления МПБ к 1 л мясного бульона добавляют 5...10 г пептона (первый продукт гидролиза белка с высокой молекулярной массой) для повышения калорийности среды и 5 г поваренной соли для создания осмотической активности. Среду нагревают до растворения пептона, постоянно помешивая.
Затем устанавливают нейтральную или слабощелочную реакцию среды, приливая 20 %-й раствор №2С03 до посинения влажной красной лакмусовой бумажки (фенолфталеин не показывает щелочную реакцию - при добавлении его к среде в фарфоровой чашке розовая окраска не появляется). Удобно использовать индикатор бромтимолблау, одну-две капли которого вносят стеклянной палочкой в фарфоровую чашку и добавляют каплю бульона. В нейтральной среде бромтимолблау буты-лочно-зеленый, в кислой - желтый, в щелочной - синий.
После установления реакции среду снова кипятят 5...10 мин и белки, свернувшиеся от изменение реакции, отфильтровывают через бумажный фильтр без осветления бульона или осветляют бульон белком. В последнем случае свежий яичный белок взбивают с двойным по объему количеством воды и смешивают с охлажденным до 50 °С бульоном. Смесь кипятят на слабом огне 10 мин, помешивая, затем фильтруют. Прозрачный мясо-пептонный бульон разливают в пробирки, закрывают ватными пробками и стерилизуют при 120 °С 20 мин.
4.2.3. Мясо-пептонный агар (МПА). Добавляют к 1 л МПБ 15...20г мелко нарезанного агар-агара. Среду нагревают до растворения агар-агара (температура плавления его 100°С, застывания 40 °С), устанавливают слабощелочную реакцию среды 20 %-м раствором №2С03 и через воронки разливают в пробирки (приблизительно по 10мл агар-агара столбиком для разлива в чашки Петри, по 5 мл - для получения скошенного, наклонного агара).
При разливе необходимо следить за тем, чтобы края пробирки были сухими, иначе пробки будут прилипать к стеклу. Пробирки со средой стерилизуют 20 мин в автоклаве при 120 °С.
4.2.4. Мясо-пептоннал желатина (МПЖ). Вносят в 1 л-мясо-пептонно-го бульона 100...150г желатины. Температура плавления желатины зависит от ее концентрации в среде: 10%-я желатина плавится при 24°С, 15%-я - при 25 °С. В летнее время среды готовят, добавляя 15 % желатины.
После растворения желатины при осторожном нагревании устанавливают слабощелочную реакцию среды (как для МПБ и МПА), кипятят 5 мин, затем охлаждают до 40...50 °С. Одновременно яичный белок взбивают с небольшим количеством воды, вливают его в охлажденную желатиновую среду, хорошо взбалтывают и снова нагревают. Среда после выпадения белков становится прозрачной. Ее фильтруют через горячую воронку, разливают в пробирки и стерилизуют в кипятильнике Коха текучим паром, прогревая среду три раза по 30 мин каждые 24 ч.
4.2.5. Картофельный агар. Нарезают ломтиками 200 г очищенного и промытого водой картофеля, заливают 1 л водопроводной воды, варят 30 мин. Отвар фильтруют через вату и добавляют воду до первоначального объема. К полученной жидкости прибавляют 2 % агар-агара, кипятят до его растворения и устанавливают нейтральную реакцию среды (рН 7). Среду стерилизуют 20 мин при 1 атм)*.
4.2.6. Пивное сусло. Зерна ячменя замачивают в холодной воде и проращивают при 35 °С. После того как ростки станут вдвое больше длины зерна, последнее высушивают до воздушно-сухого состояния (можно при слабом подогревании) и получают солод. Для приготовления сусла солод крупно размалывают и 250 г его берут на 1 л воды. Для лучшего выделения фермента амилазы смесь подогревают при 57 °С до исчезновения реакции на крахмал (синее окрашивание с йодом). Пробы на осахаривание крахмала проводят в фарфоровой чашке в капле
жидкости.
Сусло процеживают через вату, затем фильтруют через бумажный фильтр. Такое сусло содержит 10...20 % сахара. Точное его содержание определяют по плотности раствора при помощи сахариметра. Сусло разбавляют водой до концентрации сахара 6...8 % и стерилизуют 30 мин при 115 °С и давлении 0,5 атм.
Готовое сусло можно получить на пивоваренном заводе.
4.2.7. Сусло-агар. К приготовленному пивному суслу добавляют 2,5...3 % агар-агара, кипятят до расплавления, фильтруют через вату и стерилизуют таким же способом, как пивное.
4.2.8. Обезжиренное молоко. Для приготовления питательных сред используют снятое молоко, так называемый обрат, так как жир в молоке неблагоприятно влияет на рост некоторых микроорганизмов. Обрат получают сепарированием молока, нагретого до 34 °С. Можно удалять жир и при отстаивании молока.
При стерилизации следует учитывать, что молоко нельзя длительное время выдерживать в автоклаве, так как лактоза (молочный сахар), содержащаяся в молоке, может карамелизоваться. Обезжиренное молоко разливают в стерильные пробирки и выдерживают 10 мин при 115 °С и давлении 0,5 атм. Перед стерилизацией кис-лостность обрата не должна превышать 22°Т(см. с. 71), иначе молоко свернется. После стерилизации его выдерживают трое суток в термостате при 30 °С, чтобы спровоцировать развитие спорообразующих и других стойких к нагреванию форм. Через три дня пробирки с молоком просматривают и те из них, в которых развились микроорганизмы, выбраковывают.
При стерилизации в автоклаве иногда наблюдают побурение молока вследствие карамелизации мрлочного сахара и пептонизации казеина. При длительной стерилизации на дно пробирки выпадает осадок казеина, который может частично пептонизироваться. Перегретое побуревшее молоко как среду использовать нельзя.
v/ 4.2.9. Дрожжевые среды. Дрожжевая вода: 50...100 г сухих дрожжей размешивают в 1 л воды, кипятят 10 мин, фильтруют через бумажный фильтр и стерилизуют текучим паром по 30 мин ежедневно в течение трех суток.
Дрожжевой автолизат: 200 г прессованных дрожжей разводят в 1 л воды, добавляют 2 г №2НР04, 1 н. раствор №ОН (до рН6,1) и 5 мл хлороформа; выдерживают при 37 °С двое суток, доводят до рН 7,4, кипятят 30 мин, фильтруют через фумажный фильтр, разливают в посуду и стерилизуют 30 мин при 115 °С.
Дрожжевой экстракт: 1 кг прессованных дрожжей разводят в 1 л воды, смесь кипятят 1 ч, трижды фильтруют через бумажный фильтр и стерилизуют 30 мин при 115 °С.
4.2.10. Бобовый отвар. Заливают 50 г фасоли (лучше белой) 1 л водопроводной воды и варят до готовности так, чтобы бобы не разварились. Полученный отвар фильтруют через вату, добавляют к нему Юг сахара и доводят водой до первоначального объема. Устанавливают слабощелочную реакцию среды, разливают в колбы и стерилизуют 30 мин в автоклаве при давлении пара 1,5 атм.
Не надо
Размножение бактерий в жидкой питательной среде. Бактерии, засеянные в определенный, но не изменяющийся объем жидкой питательной среды, размножаясь, потребляют питательные элементы. Это в дальнейшем приводит к истощению питательной среды и прекращению роста бактерий. Культивирование бактерий в такой системе называют периодическим, а культуру - периодической. Если же условия культивирования поддерживаются путем непрерывной подачи свежей питательной среды и оттока такого же объема культуральной жидкости, то такое культивирование называется непрерывным, а культура - непрерывной.
При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры.
Рост периодической культуры бактерий подразделяют на несколько фаз, или периодов: 1) лаг-фаза; 2) фаза логарифмического роста; 3) фаза стационарного роста, или максимальной концентрации бактерий; 4) фаза гибели бактерий.
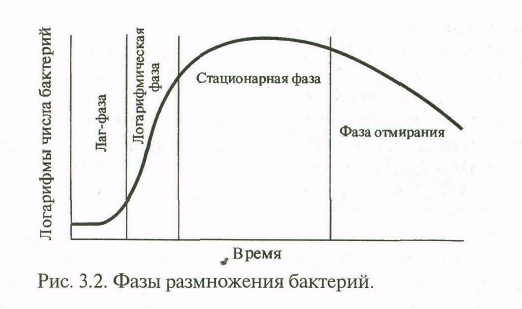
Эти фазы можно изобразить графически в виде отрезков кривой размножения бактерий, отражающей зависимость логарифма числа живых клеток от времени их культивирования (рис.3.2).
Лаг-фаза (от англ. lаg — запаздывание) — период между посевом бактерий и началом их размножения. Продолжительность лаг-фазы составляет в среднем 4—5 ч. Бактерии при этом увеличиваются в размерах и готовятся к делению, активизируются ферменты, повышается количество нуклеиновых кислот, особенно РНК (что необходимо для синтеза белков), белка и других компонентов клетки.
Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий продолжительностью около 5—6 ч. Клетки размножаются с максимальной для данной культуры скоростью (т.к. еще не действуют лимитирующие факторы). При оптимальных условиях роста бактерии могут делиться каждые 20—40 мин (время генерации — интервал между делениями клетки). Во время этой фазы бактерии наиболее ранимы, что объясняется высокой чувствительностью интенсивно растущей клетки к ингибиторам синтеза белка, нуклеиновых кислот и др.
Затем наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень (М-концентрация). Ее продолжительность выражается в часах и колеблется в зависимости от вида бактерий, особенностей их культивирования.
В ходе интенсивного роста и размножения внутри закрытой системы возрастает негативное влияние лимитирующих факторов: истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Наступает фаза гибели, характеризующаяся отмиранием клеток. Продолжительность этой фазы колеблется от десятков часов до нескольких недель. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе от оптимального состава питательной среды, окислительно-восстановительного потенциала, рН, температуры и др.
Если к бактериям постоянно добавлять питательную среду и одновременно удалять продукты обмена, можно поддерживать бактериальную культуру в логарифмической фазе роста. Для этого применяют хемостат.
